Для сложных реакций, состоящих из нескольких стадий (простых, или элементарных реакций), механизм - это совокупность стадий, в результате которых исходные вещества превращаются в продукты. Промежуточными в-вами в этих реакциях могут выступать как молекулы, так и свободные атомы, ионы, радикалы, ион-радикалы, карбены, электроны, возбуждённые частицы. Стехиометрия, ур-ние сложной реакции как правило не отражает её механизм. Элементарные реакции классифицируют по числу частиц, подвергающихся превращению в элементарном акте (моно-, би-, тримолекулярные реакции). В механизм элементарной реакции входят также физ. процессы передачи энергии, которые лежат в основе активации и дезактивации реагирующих частиц. Выяснение М. х. р. необходимо для того, чтобы управлять реакциями - влиять на их скорость и направление.
Элементарная реакция - единичный акт образования или разрыва химической связи при непосредственном взаимодействии частиц (молекул, ионов, радикалов).
Реакции, которые идут в одну стадию, называются простыми (элементарными) реакциями, а реакции, включающие несколько стадий - сложными.
Молекулярность и порядок реакций
Число молекул, участвующих в элементарном акте химического взаимодействия, называется молекулярностью реакции. По числу молекул, принимающих участие в элементарном акте химического превращения, различают реакции моно (одно), би (2) тримолекулярные реакции. Вероятность соударения одновременно большего числа частиц очень мала; поэтому тримолекулярные реакции очень редки, а 4х неизвестны.
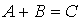
| 
| 
| |

| 
| ||
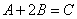
| |||

| тримолекулярная |
Сумма показателей степеней в кинетических уравнениях называется порядком реакции. Порядок реакции определяет характер зависимости V от С.
В тех случаях, когда процесс многостадиен, запись уравнения реакции лишь фиксирует исходное и конечное состояние системы, не раскрывая механизма процесса.
Если различие концентраций реагентов велико, то порядок реакции не совпадает с её молекулярностью.
Существуют реакции нулевого порядка, например, разложение некоторых соединений на поверхности различных фаз.
Порядок химической реакции
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакция нулевого порядка

График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции
Кинетическое уравнение имеет следующий вид

Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Реакция первого порядка

График зависимости концентрации реагента A для первого порядка реакции
Кинетическое уравнение реакции первого порядка

Приведение уравнения к линейному виду даёт уравнение:
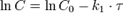
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:

Период полупревращения:

Реакция второго порядка
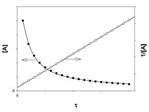
График зависимости концентрации реагента A для второго порядка реакции
Для реакций второго порядка кинетическое уравнение имеет следующий вид

или
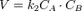
В первом случае скорость реакции определяется уравнением

Линейная форма уравнения:

Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:

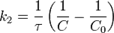
Во втором случае выражение для константы скорости реакции будет выглядеть так:

Период полупревращения (для случая равных начальных концентраций!):

Молекулярность реакции
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
Радиоакти́вныйраспа́д — спонтанное изменение состава или внутреннего строения нестабильныхатомных ядер (заряда Z, массового числа A) путём испускания элементарных частиц, гамма-квантов и/или ядерных фрагментов. Процесс радиоактивного распада также называют радиоакти́вностью, а соответствующие ядра (нуклиды, изотопы и химические элементы) радиоактивными. Радиоактивными называют также вещества, содержащие радиоактивные ядра. 
Время полупревращения определяется как время, в течение которого концентрация реагирующего вещества уменьшается наполовину от своей первоначальной величины.
Пери́одполураспа́да (частицы, ядра, атома, энергетического уровня и т. д.) — время T ½, в течение которого система распадается с вероятностью 1/2.
Не следует считать, что за два периода полураспада распадутся все частицы, взятые в начальный момент. Поскольку каждый период полураспада уменьшает число выживших частиц вдвое, за время 2 T ½ останется четверть от начального числа частиц, за 3 T ½ — одна восьмая и т. д. Вообще, доля выживших частиц (или, точнее, вероятность выживания p для данной частицы) зависит от времени t следующим образом:
 .
.
Правило Вант-Гоффа
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
 где
где  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Уравне́ниеАрре́ниуса устанавливает зависимость константы скорости  химической реакции от температуры
химической реакции от температуры  .
.
Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации  ), чтобы этот барьер преодолеть.Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений
), чтобы этот барьер преодолеть.Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений  на 10 %.
на 10 %.
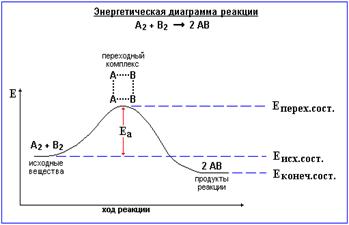 Энергия активации в (химии) — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоуляхна моль), чтобы произошла реакция.
Энергия активации в (химии) — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоуляхна моль), чтобы произошла реакция.

