КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Сложные соединения, в узлах кристаллической решетки которых находятся сложные частицы, способные к самостоятельному существованию при переходе вещества в расплавленное или растворенное состояние, называются комплексными соединениями
[Сu (NH3)4]SO4 → [Сu (NH3)4]2+ + SO42-
(Тетраамминосульфат Сu) внутренняя и внешняя сферы
Внутренняя сфера – комплекс (в квадратных скобках):
а) Анионный [Zn (CN)4]2- б) Катионный [Сu (NH3)4]2+
в) Нейтральный [Pt (NH3)2 Cl2] (не имеет внешней сферы)
Состав комплекса: Комплексообразователь (катион или атом) и Лиганды (анионы или молекулы)
Лиганды:
- простые анионы (OH-,F-,Cl-, Br -,S2-),
сложные анионы (CN-, NCS -, NO2-),
нейтральные молекулы Н2O, NH3, CO, H2NCH2CH2NH2 (En)
- монодентантные, бидентантные (по числу занимаемых орбиталей комплексообразователя)
Координационное число (к.ч.) – количество лигандов, координируемых комплексообразователем
Химическая связь в комплексных соединениях
Между внешней и внутренней сферой – электростатическое ион-ионное взаимодействие
Между комплексообразователем и лигандами – ковалентная связь по донорно-акцепторному механизму
Теория валентных связей (ВС)
Между комплексообразователем и лигандами возникают ковалентные связи, образованные по донорно-акцепторному механизму.
донор – лиганд (поставщик пары электронов) акцептор – комплексообразователь (наличие свободных АО)
Все вакантные орбитали комплексообразователя, принимающие участие в образовании связи, одинаковы по энергии и по форме т.е. они гибридизованы.
Комплекс [AlBr4]
Атом Аl …3 s 23 р 1
комплексообразователь Al3+:



 ...3 s 03 p 0
...3 s 03 p 0
 |  |  | 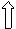 | ||||
:Br:Br:Br:Br
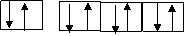 |
 :Br
:Br
неподеленные пары электронов лиганда
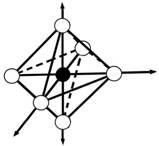
sp 3 -гибридизация орбиталей => Строение комплексного иона - тетраэдр
Комплексообразователь - d-элемент
орбитали лигандов, внедряясь в электронную оболочку комплексообразователя, оказывают влияние на состояние электронов на d - орбиталях.
Неспаренные электроны, испытывая отталкивание от электронных пар лигандов, могут спариваться, переходя на более дальние от лигандов d- орбитали центрального атома.
· Лиганд сильного поля (электроны на d-подуровне комплексообразователя максимально спариваются)
· Лиганд слабого поля (спаривание электронов на d-подуровне комплексообразователя не происходит)
Для 4 d -и 5d-элементов – все лиганды сильного поля
Для 3 d -элементов - спектрохимический ряд лигандов
I<Br<Cl<ОН<F<H2O<NCS<NH3<En<NO2<CN<CO
(в порядке возрастания силы поля)
Но границы между сильным и слабым полями лигандов провести сложно.
[MnF6]2-лиганд F -слабое поле;[NiF6]2-лиганд F - сильное поле
Комплекс [Fe(CN)6]3-
Комплексообразователь Fe3+:… 3d54s0.
Лиганды CN¯ - лиганды сильного поля,
|


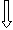
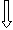



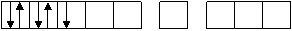
Fe+3
3 d 4 s 4 p
d2sp3-гибридизация орбиталей
структура - октаэдр, комплекс- внутриорбитальный,
парамагнитный, т.к. есть один неспаренный электрон
Тип гибридизации и структура комплексов
| К.ч. | комплек- сообра-зователь | лиганды | Гибридизация орбиталей | Структура комплекса |
| любой | sp | линейная | ||
| 3 d -элемент | слабого поля | d3s, d2sp, sp3 | тетраэдр | |
| 3 d -элемент | сильного поля | dsp2 | Плоский квадрат | |
| 4 d, 5 d -элемент | Все сильного поля | dsp2 | Плоский квадрат | |
| любой | d2sp3, sp3d2, dsp3d | октаэдр |