Полимеразная цепная реакция (ПЦР - PCR – polymerase chain reaction) — экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов ДНК в биологическом материале. Метод основан на многократном избирательном копировании определённого участка нуклеиновой кислоты ДНК при помощи ферментов в искусственных условиях (in vitro). При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от амплификации ДНК в живых организмах (репликации), с помощью ПЦР амплифицируются (многократно копируются) относительно короткие участки ДНК. В обычном ПЦР-процессе длина копируемых ДНК-участков составляет не более 3000 пар оснований. С помощью смеси различных полимераз с использованием добавок и при определённых условиях длина ПЦР-фрагмента может достигать 20-40 тысяч пар нуклеотидов. Это всё равно значительно меньше длины хромосомной ДНК эукариотической клетки. Обычно при проведении ПЦР выполняется 20-35 циклов.
Реакция ПЦР состоит из нескольких десятков циклов, в ходе каждого из которых выделяют три этапа (рис. 4).
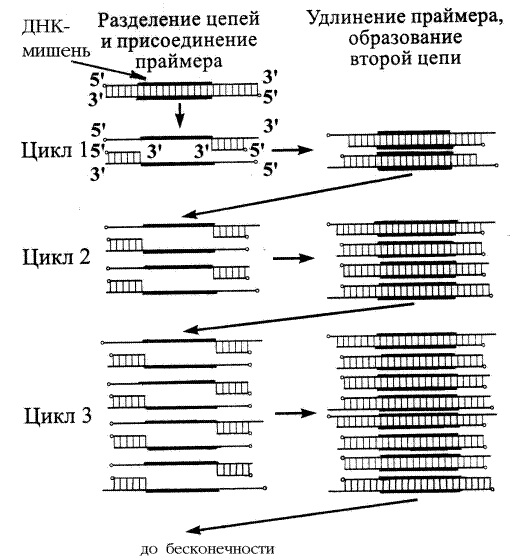
Рис. 4. Схема полимеразной цепной реакции [по Мюллис, 1990].
Первый этап — денатурация ДНК. Она осуществляется при нагревании реакционной смеси до +93 – +95 °С. Происходит разрушение водородных связей, соединяющих комплементарные цепи, и разъединение цепей исходной молекулы ДНК. В таком состоянии каждая цепочка может служить матрицей для репликации.
Второй этап — отжиг праймеров при охлаждении реакционной смеси. Для каждой пары праймеров существует своя температура отжига, значения которой располагаются в интервале от +50 до +65°С. Важнейшая характеристика праймеров — температура плавления (Tm) комплекса праймер—матрица. Она определяется как температура, при которой половина сайтов связывания праймера занята. Tm можно приблизительно определить по формуле: Tm = 2(A + T) + 4(G + C). Если праймер короткий, а Tm мала, то праймер может оказаться частично комплементарен другим участкам матричной ДНК, что может привести к появлению неспецифических продуктов. Сверху температура плавления ограничена оптимумом действия полимеразы.
Третий этап — элонгация (удлинение цепочки ДНК). После гибридизации матрицы с праймером последний служит затравкой для ДНК-полимеразы при синтезе комплементарной цепи матрицы. Синтез ДНК идет от 5’ к 3’-концу в обоих направлениях, начиная с участков присоединения праймеров. Таким образом, наращивание праймеров происходит навстречу друг другу. Материалом для синтеза новых цепей ДНК служит добавляемая в буферный раствор смесь четырех дезоксирибонуклеотидтрифосфатов (дНТФ). Процесс происходит при температуре от +70 до +72°С.
В следующем цикле амплификации только что синтезированные фрагменты ДНК (ампликоны) служат матрицей для синтеза новых цепей, т.е. в каждом цикле число амплифицируемых фрагментов ДНК удваивается. В ходе одного цикла ПЦР количество фрагмента, ограниченного местами отжига праймеров, увеличивается в два раза. За N циклов реакции количество амплифицируемого фрагмента увеличивается в 2N раз. Поэтому, даже если в исходном растворе первоначально находилась только одна двухцепочечная молекула ДНК, то за 30-40 циклов амплификации синтезируется около 1 млрд. копий фрагментов (ампликонов), что по времени занимает 3-4 часа.
В настоящее время в ПЦР в подавляющем большинстве случаев используют ДНК-полимеразу термофильной бактерии Thermus aquaticus (Taq-полимераза), выделенную и охарактеризованную в 1980 году советскими учёными А. С. Калединым, А. Г. Слюсаренко и С. И. Городецким из ВНИИ генетики. Температурный оптимум реакции, направляемой Taq-полимеразой, находится в районе +70°С. Другим важным свойством является то, что данная полимераза не инактивируется после длительной инкубации при +95°С. Используя Taq-полимеразу, удалось решить сразу две проблемы. Во-первых, термостабильная полимераза не инактивируется на этапе денатурации ДНК, поэтому нет необходимости после каждого цикла реакции добавлять новую порцию фермента. Это упрощение процедуры позволило автоматизировать проведение ПЦР, т. к. теперь требовалось лишь перенести образец с определённым интервалом времени в разные температурные условия: +90 – +95°С (температура денатурации) и +50 – +72°С (температура ренатурации ДНК и ферментативной реакции). Во-вторых, высокий температурный оптимум реакции, катализируемой Taq-полимеразой, позволяет подбирать жёсткие температурные условия отжига, обеспечивающие гибридизацию праймеров только в заданном районе изучаемого генома, что существенно повышает специфичность и чувствительность метода. Однако, у Taq-полимеразы есть и свои недостатки, например, сравнительно низкая точность, а также способность добавлять аденозинмонофосфаты к 3’-концу ДНК.
Материалы и оборудование:
Вортекс, амплификатор, ДНК-матрица, праймеры, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК, 5Х Мастер-микс (Евроген, Россия), деионизованная вода.
Ход работы:
1. Аккуратно смешать в пробирке на 0,2 мл следующие компоненты:
5Х Мастер-микс – 5 мкл;
прямой праймер – 1 мкл;
обратный праймер – 1 мкл;
матрица – 0,5-5 мкл;
деионизованная вода – до 25 мкл.
Примечание
Чтобы избежать получения неспецифических продуктов реакции, следует соблюдать стерильные условия и вносить каждый образец новым наконечником.
2. Поместить пробирки в амплификатор.
3. Запустить программу:
первоначальный прогрев при 95°С – 4 минуты;
35 циклов:
денатурация при 95°С в течение 30 секунд;
отжиг праймеров при 54°С в течение 30 секунд;
элонгация цепи при 72°С в течение 45 секунд.
Инкубирование смеси при 72°С в течение 5 минут.
4. После окончания реакции проверить наличие продукта при помощи электрофореза в агарозном геле. Пример результата ПЦР представлен на рис. 5.
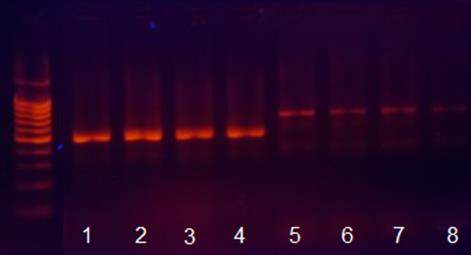
Рис. 5. Продукты реакции ПЦР различной длины (500 и 700 п.н.).