В термодинамических системах происходят термодинамические процессы – переход системы из одного состояния в другое, причем различают термодинамические процессы:
1. квазистатические - обратимые;
2. нестатические - необратимые.
Обратимые процессы допускают возвращение термодинамической системы в первоначальное состояние без изменений в окружающей среде, такие процессы встречаются только в изолированных термодинамических системах (термос). Однако это идеализированная система, ибо в природе не встречается.
Необратимые характерны для закрытых и открытых систем, все процессы протекают с конечной скоростью, они необратимы. Поэтому какой-либо процессы не протекал бы, он всегда имеет окончание.
Термодинамические процессы, протекающие в системах, подчиняются двум законам (началам) термодинамики
Первый закон был установлен в 1848 году немецким врачом Робертом Майером: «Энергия в изолированных системах не может увеличиваться или уменьшаться, а может переходить из одного вида в другой».
Возникновение первого закона связано с началом изучения физиологических процессов, аналогичен закону сохранения энергии Ломоносова, однако Михаил Васильевич не опирался столь на физиологию.
В путешествии на шхуне Майер отметил, изучая работы Лавуазье, что при жарких температурах происходит меньшее потребление энергии. По прибытии на сушу у членов экипажа началась лихорадка, с лечебными целями делали кровопускания. Майер обнаружил, что во время осуществления кровопускания венозная кровь очень яркая, насыщенная, похожа на артериальную. Сделал заключение, что в условиях жаркого климата кислорода из крови на окислительные процессы тратится меньше. Далее пришел к выводу, что энергия, которая поступает в организм, равна тому количеству энергии, которое выделяется. Изучение чисто физиологических явлений легли в основу фундаментального закона сохранения и превращения энергии.
В неизолированных термодинамических системах изменение ой самой системой: ∆U=Q-A. внутренней энергии равно разности между полученным количеством теплоты Q и работой A, совершаем
Внутренняя энергия является суммой кинетической и потенциальной энергии, изменяется в процессе совершения работы и теплопередачи.
|
|
|
теплопередача
конвекция
излучение
Следствие первого закона термодинамики - правило Гесса 1836 год: «Термодинамический процесс, развивающийся через ряд промежуточных реакций, не зависит от промежуточных стадий, а определяется лишь начальным и конечным состоянием системы».
∆U = U1-U2, где U1 - энергия начального состояния, U2 - энергия конечного состояния, ∆U- изменение внутренней энергии.
Отношение работы к количеству тепла, сообщенного системе, есть величина постоянная:
A/Q =1 – T2/T1, T2<T1, A/Q=const, 1ккал – 427 кг/м, 1 кал – 4,184 Дж.
В живых организмах совершаются различные виды работы, источником поступления энергии являются химические вещества, мы являемся хемотрофами. Лишь у растений из воды, углекислого газа и минеральных веществ синтезируются органические соединения, которые являются началом жизни, ибо они поглощаются травоядными животными, которых поедают плотоядные, а также и мы. Таким образом, мы получаем солнечную энергию в виде энергии химических связей, которая превращается в энергию макроэргических соединений - «универсальная валюта обменных процессов».
При превращении энергии происходит образование тепла. Различают первичную теплоту – результат теплового рассеивания энергии в ходе обмена веществ и в ходе протекающих химических и биохимических реакций. Но химические реакции, которые протекают в организме, дают нам возможность совершения разных форм работы: поддержание осмотичности, свечение, совершение механической работы и другие виды. Какую бы работу мы не совершали конечный итог – тепловая энергия. Та тепловая энергия, в которую переходят различные виды работ – вторичная теплота, пропорциональна активности ткани, причем основным источником вторичной теплоты будут являться мышцы.
Производились следующие исследования термодинамических процессов в биологических системах:
1. Лавуазье и Лаплас при помещении морской свинки в ледяную каломель, сравнивали количество энергии, поступающей с пищей, и количество выделившегося тепла. Обнаружили, что эти показатели одинаковы. Питательные вещества, которые окисляются в организме, дают такое же количество энергии, как и при сгорании тех же веществ в калориметре.
2. Уоттер изучал энергетический баланс в организме, какое количество энергии выделялось при сжигании жиров, белков и углеводов. При изучении сжигания веществ в калориметре выделялось 1859 ккал, разница 20 ккал. Разница обусловлена тем, что в таких исследованиях возможна ошибка, или же часть энергии запасалась на структурных компонентах протоплазмы клеток.
Эти исследования показали, что первый закон термодинамики и его следствие применимы к биологическим объектам, при этом учитывается количество энергии, поглощенной с пищей, и количество выделенной организмом тепловой энергии. В этом энергетическом балансе не рассматриваются промежуточные этапы превращения энергии. Первый закон характеризует лишь количественные изменения и превращения энергии в термодинамических системах, но не показывает вероятности процесса и его направленности.
Второй закон термодинамики был установлен Карно и Клаузисом: «Для совершения работы одного лишь наличия энергии недостаточно. Для совершения работы необходимо наличие разности потенциалов энергетических уровней».
Таким образом, второй закон показывает направленность изменений, которые происходят в термодинамических системах, ибо самопроизвольно теплота переходит лишь от нагретого тела к более холодному, от вещества с большей концентрацией в сторону меньшей.
Для работы необходимо создание и поддержание градиента параметра – отношение разности величин параметра в двух точках к расстоянию между ними (концентрационный, электрохимический градиент, градиент автоматии в проводящей системе).
Первый закон термодинамики дает на возможность представления о том, что некоторые явления могли бы произойти, однако этого не происходит, ибо, роняя предмет со стола, он обратно не возвращается, хотя первый закон это допускает. При падении потенциальная энергия покоящегося тела переходит в кинетическую энергию движения. При соударении кинетическая энергия движения переходит в тепловую энергию. По первому закону все происходит в эквивалентных количествах, можем допустить, что тепловая энергия переходит в кинетическую, что обеспечивает подъем, однако этого не происходит, ибо большинство процессов необратимо – пролитая вода не соберется обратно в кувшин, разбитая ваза не восстановится из осколков.
Энтропия
По мере превращения энергии системы теряют разность энергетических уровней и утрачивают способность совершать работу.
Энтропия (от греч. превращение) - мера утраты способности системы совершать работу, мера рассеяния энергии: S = Q/T, Q = S*T.
Больцман исследовал эти процессы, дал понятие энтропии.
S = K*ln W, K-постоянная Больцмана, равна 1,38 * 10-23 Дж/К.
Количество способов комбинации элементов системы, с помощью которых может быть реализовано данное состояние – термодинамическая вероятность W, следует отличать ее от математической вероятности - среднее значение частоты появлений событий при испытании P.
Термодинамическая вероятность показывает возможность расположения частиц в системе, которое может реализовать данное состояние. Например, в системе 6 молекул: 6 слева и ни одной справа, далее справа может быть 1 молекула, может быть справа 2 молекулы, а остальные слева, что показывает, в каком состоянии находится термодинамическая система. Число размещений молекул 26 = 64– термодинамическая вероятность. Положение молекул 6 слева, 0 справа - единственное состояние системы, 5 слева и 1 справа – шесть возможностей, 4 слева и 2 справа -15 размещений, 3 слева и 3 справа -20 размещений, далее изменяется все в такой же последовательности.
Математическая вероятность этих состояний 1/64 = 0,016. Такое состояние с математической точки зрения маловероятно, самой большой вероятностью будет обладать распределение 3 и 3.
Если в какой-то части термодинамической системы сконцентрировано много свободной энергии, такая система – неравновесная, энтропия такой системы буде мала, энергия будет перемещаться из области большей концентрации в область меньшей, то есть движение энергии будет упорядочено. Вероятность существования такой системы очень мала, ибо система стремится к беспорядку, стремится стать равновесной. То есть система стремится к тому, чтобы в двух ее частях энергия распределилась равномерно. Вероятность существования такой системы будет значительно больше, а энтропия равновесной системы будет велика, ибо перемещение частиц в такой системе подчиняется лишь тепловому Броуновскому движению. При этом нет определенного направления движения частиц, исходя из этого, система будет беспорядочной.
Второй закон показывает ограниченность превращения энергии в работу, ибо не вся внутренняя энергия может быть превращена в работу, КПД<1, A/Q=1-T1/T2, T1>T2.
Если возьмем температуру тела внутри человека 310 К, а снаружи 303 К, возможность совершения работы за счет тепловой энергий 2 %, но мы используем для совершения работы химическую энергию, что позволяется увеличить КПД = A/∆F ≤ 1.
Соотношение биологического процесса и КПД в %: гликолиз 36, окислительное фосфорилирование 55, фотосинтез 75, сокращение мышц 40, свечение бактерий до 96.
Живые организмы, совершая работу, не приходят в состояние термодинамического равновесия. Закрытые системы подчиняются закону увеличения энтропии, а живые организмы – открытые термодинамические системы, стремятся к минимуму энтропии. Совершая непрерывную работу, они постоянно расходуют энергию, но при этом живой организм удерживает разницу энергетических уровней. Наша деятельность направлена на поддержание градиента, что возможно благодаря поступлению в нашу систему веществ из окружающей среды, которые имеют большой запас свободной энергии. Поэтому понятие энтропии для живых организмов было заменено понятием потока энтропии.
Поступление питательных веществ в организм рассматривается как поток отрицательной энтропии, ибо в ходе обмена веществ происходит уменьшение свободной энергии и запасании энергии в живом организме (продукты, которые мы получаем, являются строго упорядоченными, а то, что выделяем – продукты беспорядочные). Энергия, которая уходит в ходе совершения работы, представляет собой поток положительной энтропии. Поток отрицательной энтропии возникает в процессе ассимиляции, а положительной - в процесс диссимиляции, что позволяет нам поддерживать стационарное равновесие.
| Термодинамическое равновесие | Стационарное равновесие |
| 1. Пример: закрытый сосуд, часть объема которого занимает жидкость, а часть пар 2. Отсутствие потока веществ в систему и из среды 3. Не нужна трата свободной энергии для поддержания равновесия 4. Свободная энергия и работоспособность системы = 0 5. Энтропия в системе равна максимальному значению 6. Отсутствие градиента в системе | 1. Пример: горящая свеча, горящая керосинка, живой организм 2. Постоянный приток веществ в систему и удаление продуктов реакции 3. Нужна постоянная трата свободной энергии для поддержания равновесия 4. Свободная энергия и работоспособность системы постоянны и неравны 0 5. Энтропия постоянна и неравна максимальному значению 6. Наличие постоянного градиента в системе |
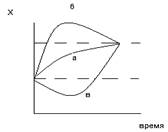 Наш организм стремится к созданию постоянной величины энтропии, но эмоциональная нагрузка и заболевания приводят к нарушению потоков энтропии, что выводит нас из состояния равновесия. Организм работает на то, чтобы при выходе из стационарного состояния вернутся к нормальному состоянию, при этом переходы могут быть различными.
Наш организм стремится к созданию постоянной величины энтропии, но эмоциональная нагрузка и заболевания приводят к нарушению потоков энтропии, что выводит нас из состояния равновесия. Организм работает на то, чтобы при выходе из стационарного состояния вернутся к нормальному состоянию, при этом переходы могут быть различными.
Экспоненциальное приближение отображает кривая А – оптимальное состояние, здесь происходит медленное возвращение к стационарному состоянию, но реакции в организме могут быть разнообразными. Кривая Б показывает возможность с избыточным отклонением, а кривая В переход к сложному старту, когда энергетические ресурсы уменьшены.
Второй закон затрагивает и состояние информации в живых объектах, ибо согласно второму закону в системе есть стремление переходить к беспорядку – универсальный закон. В организме происходят сложные реакции синтеза и восстановление структур, которые погибают. Информация на восстановление заложена в азотистых основаниях, что позволяет заменить структуры, заменить отмершие клетки и продолжить жизнь. Если способность утратится, то организм погибнет, ибо неумолимо будет действовать второй закон термодинамики, а именно будет осуществляться переход к беспорядку.
Законы термодинамики имеют приложение к биологическим объектам.
07.05.09