Следствие: Изменение энтальпии реакции равно разности суммарной энтальпии продуктов реакции и энтальпии исходных веществ.
DН0реак= åDН0прод- åD Н0исх
Таким образом, на основании закона Гесса можно рассчитать тепловой эффект реакции, не проводя эксперимента, можно термохимическими уравнениями пользоваться как алгебраическими.
Энтропия. При нагревании бертолетова соль разлагается по уравнению:
2 KClO3 (т) ® 2KCl (т) + 3О2 (г), но из KCl и О2 она не образуется.
Железо самопроизвольно корродирует, но само по себе из ржавчины не восстанавливается. Как оценить возможность того или иного процесса?
Большинство процессов представляет собой два одновременно происходящих явления: передачу энергии и изменение упорядоченности расположения частиц относительно друг друга.
Передаче энергии характеризует изменение энтальпии DН, изменение порядка расположения частиц оценивается изменением энтропии DS.
Энтропия – это мера беспорядка.
II закон термодинамики: В изолированных системах энтропия самопроизвольно протекающего процесса возрастает DS >0
В случае закрытых систем энтропия может, как возрастать, так и уменьшаться.
DS >0 DS <0
процессыпроцессы
-расширения газов - сжатия газов
- фазовые переходы: т®ж®г - конденсация и
- растворение кристаллических в-в кристаллизация в-в
Стандартная энтропия – это энтропия 1 моль вещества в его стандартном состоянии при 2980К. Имеет размерность Дж/К×моль.
Стандартные энтропии простых веществ не равны нулю. Энтропия всегда положительна, т.к. согласно III закону. В изолированных системах!!!
III закон термодинамики: Энтропия идеального ионного кристалла при температуре абсолютного нуля равна нулю.
Функция, определяющая возможность самопроизвольного протекания процесса, должна учитывать оба фактора:
1. Энтальпийный фактор – стремление системы к понижению внутренней энергии за счет экзотермической реакции (-DН)
2. Энтропийный фактор – стремление системы к неупорядоченности в расположении частиц за счет теплового движения DS.
Такой функцией является изменение свободной энергии Гиббса (при постоянных температуре и давлении) или изобарно-изотермический потенциал
DG=DH - TDS
Интерпретация DH и DG DH= DG + TDS
¯ ¯
свободная “несвободная” энергия, т.е. та,
энергия которая не переходит в работу
Свободная энергия Гиббса представляет собой ту часть изменения энтальпии, которая может использоваться для выполнения полезной работы.
Направление протекания реакций в зависимости от знаков DH и DS
| Знаки DН DS DG | Направление самопроизвольного протекания реакции | Примеры |
| - + - | Возможна при любой температуре | 2С6Н6 (ж)+14О2(г)= =12СО2 (г)+6Н2О (г) |
| + - + | Термодинамически невозможна. Возможна в обратном направлении. | N2 (г) + 2O2 (г)=2NO2 (г) |
| - + ± | Возможна при низкой температуре (ТDS мало Þ DG<0) | N2(г)+3H2(г)=2NH3(г) |
| + + ± | Возможна при высокой температуре (ТDS велико Þ DG<0) | N2O4 (г)=2NO2 (г) |
Если DG=0 система находится в состоянии динамического равновесия.
DG0реак=SDG0прод - SDG0исх.в-в
Для самопроизвольно протекающих реакций - DG < 0.
Величины DG лежат в интервале (-100)¸(-900) кДж/моль.
Методические рекомендации по выполнению задания №5
Алгоритм действия по вычислению энтальпии реакции:
1. Запишем уравнение
2. Выпишем n
3. Выпишем значения DН0
4. Проведем расчеты по формуле: DН0реак= åDН0прод-åD Н0исх
Задача 1. Определить тепловой эффект реакции взаимодействия оксида алюминия и оксида серы (YI) с образованием соли – сульфата алюминия.
Al2O3 (т) + 3SO3 (т) = Al2(SO4)3 (т) Выпишем n и DН0
n 1 3 1
DН0298 -1676 -396 -3442
DН0реак= å(n ∙DН0прод) - å(n∙ D Н0исх);
где å-знак суммирования;
n – стехиометрические коэффициенты;
DН0- стандартные энтальпии образования химических веществ;
Алгоритм действия по вычислению энтальпии реакции:
1) Составляем уравнение реакции, правым нижним индексом указываем агрегатное состояние веществ.
2) По таблице приложения находим значения DН0298 образования Al2O3, SO3, Al2(SO4)3 и под каждым химическим символом в уравнении реакции подписываем значение DН0298 , взятое из таблицы с множителем, равным стехиометрическому коэффициенту;
3) Суммируем все значения энтальпий продуктов реакции и вычитаем из них сумму энтальпий исходных веществ.
4) Расчет: DН= (-3442) – [1×(-1676) + 3×(-396)]= -578 кДж, т.е. реакция экзотермическая
Задача 2
1. 2Н2 (г) + О2 (г) = 2Н2О (ж)
2. 2 1 2
3. DН0298 0 0 -286
4. DН0реак=åDН0прод-åD Н0исх= 2×(-286) – [2×0 + 1×0]= -572 кДж
С помощью термохимических расчетов можно определить энергию химических связей: энергию кристаллической решетки, энергию межмолекулярного взаимодействия, энтальпию растворения, энергетические эффекты фазовых превращений.
Задача 5. Какой знак имеет DН, DS и TDS для экзотермической реакции:
2Н2 (г) + О2 (г) = 2Н2О (г)
Ответ: реакция экзотермическая, т.е. DН<0. При ее протекании объем системы уменьшается (из 3 моль газообразных веществ образуется 2 моль), т.е. DS<0, т.е. TDS<0.
Задача 6. В каком направлении – прямом или обратном – протекает реакция?
2Н2 (г) + О2 (г) = 2Н2О (г)
при:
а) Т=2980К (250С), если DН= -484 кДж, TDS= -26 кДж
б) Т=10000К (7370С), если DН= -484 кДж, TDS= -890 кДж
Решение:
Реакция возможна, если удовлетворяется условие:
DН - TDS<0
Подставим значения DН и TDS в это выражение.
А) при Т=2980К
-484-(-26)=-458 кДж, т.е. протекает в прямом направлении, ее осуществление обуславливает энтальпийный фактор.
Б) Т=10000К
-484-(-890_=406 кДж, в прямом направлении невозможна из-за энтропийного фактора TDS (по абсолютной величине)>DН.
Задача 6. Относится ли следующая реакция
2 KClO3 (т) ® 2KCl (т) + 3О2 (г) DН<0
к обратимым?
Решение:
Эта реакция протекает с увеличением энтропии DS>0 (из 2 моль получили 5).
Вывод: Эта реакция будет протекать при любых условиях, т.к. DН <0, а произведение TDS>0, а перед ним стоит знак минус. Следовательно, DG=DH - TDS всегда <0.
Задача 7.
Возможно ли протекание реакции восстановления оксида железа (III) водородм при стандартных условиях, если DS=0,1387 кДж/моль 0К? При какой температуре будет проходить этот процесс?
Fe2O3 + 3H2 = 2 Fe + 3H2O, DH=96,61 кДж
Решение:
Вычислим DG=DH - TDS= 96,61- 298×0,1387=55,28 кДж/моль
DG>0, поэтому в стандартных условиях эта реакция невозможна, наоборот при этих условиях идет коррозия (реакция окисления железа).
Вычислим температуру, при которой эта реакция становится возможной (Равновесие: DG=0 Þ DН=ТDS).
Отсюда 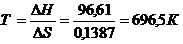
Следовательно, при Т~696,50К начинается реакция восстановления оксида железа (III).