Окислительно-восстановительные и электрохимические процессы.
Основные параметры, используемые для характеристики растворов
| Ионное произведение воды | Кw = [H+] [OH-] = const, [H+] [OH-] = 10-14 (при Т=298К) | Величина постоянная при данной температуре для воды и равная произведению концентрации ионов водорода и гидроксид-ионов. |
| Водородный показатель сильной кислоты (См>0,1) | рН= -lg[H+], рН= -lg a(H+) | Количественная характеристика кислотности среды, равная отрицательному десятичному логарифму активной концентрации свободных ионов водорода в растворе |
| Гидроксильный показатель рОН сильного основания | рОН= -lg[ОH-] | Количественная характеристика щелочности среды, равная отрицательному десятичному логарифму концентрации свободных ионов ОН- в растворе |
| Слабая кислота | рН=1/2(рКкисл -lgCкисл) | рН<7 |
| Слабое основание | рН=14-1/2(рKосн-lgCосн) | рН>7 |
| Буферный раствор из слабой кислоты и ее соли | 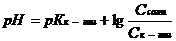
| рН<7 |
| Буферный раствор из слабого основания и его соли | 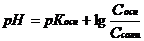
| рН>7 |
| Константа диссоциации | К = [H+][A-] / [HA] | Константа равновесия процесса диссоциации кислоты НА |
| Степень диссоциации | α = Ci / Co, | Отношение числа продиссоциированных молекул к общему числу молекул электролита. Степень диссоциации возрастает при разбавлении раствора, при повышении температуры. |
| Закон разведения Освальда | K = ca2/ 1-a; a≈√ K/C | С уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается |
Теоретическая часть
Реакции в природе происходят, в основном, в растворах, имеющих разный состав и структуру. Основные признаки растворов – это однородность и устойчивость во времени.
Растворы – однородные (гомогенные) системы, состоящие из двух или более компонентов (составных частей) и продуктов их взаимодействия.
Пример: раствор серной кислоты Н2SО4 состоит из:
1. растворителя – воды
2. растворенного вещества – кислоты
3. гидратированных ионов: Н+, НSО4-, SО42-
По агрегатному состоянию растворы классифицируют на:
- жидкие (растворы солей в воде)
- твердые (сплавы: никеля и меди, серебра и золота)
- газообразные (смеси газов, воздух)
По качественному составу растворы подразделяются на:
- концентрированные, разбавленные;
- насыщенные, пересыщенные, ненасыщенные.
Растворение начинается с того, что молекулы растворителя распределяются между молекулами растворяемого вещества. Это происходит в том случае, если силы притяжения между молекулами растворителя, с одной стороны, растворителя и растворяемого вещества – с другой, примерно одинаковы. Вода и бензин не смешиваются. Поскольку полярные молекулы воды сильно притягиваются друг к другу, и молекулы углеводорода не могут проникать между ними. В то же время бензин легко смешивается с тетрахлоридом углерода, причем и тот, и другой служат хорошими растворителями для многих нерастворимых в воде неполярных веществ, таких, как жиры или парафины. Вода в свою очередь, растворяет большинство ионных веществ, а также полярные соединения, такие, как спирт, сахар, крахмал. Ни одно из этих веществ не растворяется ни в бензине, ни в других углеводородах. При растворении ионных соединений в воде или других полярных растворителях ионы «вытягиваются» из кристаллической решетки силами притяжения молекул растворителя. При этом они сольватируются, т.е. более или менее прочно связываются с молекулами растворителя.
Иногда вещество начинает растворяться в результате химической реакции, которая изменяет его свойства.
Количественной характеристикой растворов является концентрация.
Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объёме раствора или растворителя.