Если гипертрофическая тренировка приводит к большему количеству миоядер, это может быть условием для долгосрочного преимущества, даже если гипертрофический стимул исчезает. Это преимущество может проявляться как устойчивость к отсутствию тренировки и связанной с ней атрофией и эффективный отклик на последующую тренировку. Мы воспользовались моделью перегрузки на крысах. Исследования облучения показывают, что активация клеток-сателлитов является необходимым условием для гипертрофии (25) и гипертрофия развивается весьма медленно, так что добавление ядер и увеличение волокна можно отделить друг от друга (25, 26). Чтобы исключить влияние типа волокон изучались только мышечные волокна IIb типа (рис. 5а). После 14 дней перегрузки количество миоядер на одно волокно было увеличено на 30% (P <0,0001; рис 5B). В то время как в среднем, площадь поперечного сечения увеличилась недостоверно на 16 % (рис. 5C). Впоследствии оба типа: контрольные и перегруженные мышцы были денервированны. После двух недель неиспользования мышцы в обеих группах были атрофированы, но в группе, где мышцы были ранее перегружены, атрофия была меньше. К концу эксперимента площадь поперечного сечения у перегруженных мышц была на 33% больше, чем у мышц, не испытывающих перегрузки (рис. 5C).

Рисунок 5.Предыдущая гипертрофическая тренировка замедляет атрофию, возникающую при денервации мышцы
(А) Микрофотография окрашенного волокна, миозин тяжелой цепи IIb (зеленый), дистрофин (красный), и ядра (синий). Стрелками указаны миоядра, которые определяются наличием в центре пятна Hoechst в пределах дистрофинового кольца.
(B) количество ядер в мышечных волокнах IIb типа в нормальной (Con.) и перегруженной (Overl) мышцах. *** Статистическая значимость (р <0,0001). (С) размер мышечного волокна в перегруженных мышцах в течение 14 дней (Overl.), в мышцах контрольной группы (Con.) и в перегруженных 14 дней мышцах, которые были затем денервированны в течение 14 дней (Overl. + ден.) относительно мышц денервированных в течение 14 дней(Den.). # # Статистическая значимость от денервированных мышц (P <0,001).
ОБСУЖДЕНИЕ
Мы показали, что увеличению размера волокон при гипертрофии перегрузкой предшествует увеличение количества ядер, таким образом, что увеличение размера мышечных волокон может быть причинно связано с более высокой общей мощностью синтеза белка от большего количества миоядер. Увеличение ядер, кажется, достаточно устойчивое и не зависит от существующей гипертрофии, потому что даже в сильно атрофированных волокнах поддерживалось повышенное количество миоядер после трех месяцев денервации.
Наши данные не подтверждают простую парадигму о постоянном объеме мионуклеарного домена, в котором ядра приобретаются посредством гипертрофии, а затем теряются во время атрофии. Таким образом, мы хотели бы предложить другую модель (рис. 6), в котором мышечные волокна, не подвергшиеся тренировке, приобретают новые ядра при «первом тренировочном маршруте». Эти вновь приобретенные ядра причинно связаны с последующим увеличением волокна, например, потому что ограничения в синтетической способности для каждого ядра может быть слишком мало, чтобы поддерживать большой домен без увеличения их количества. При последующем отсутствии тренировки мышечные волокна поддерживают повышенное число ядер, которые могут предоставлять сопротивление атрофии. При последующей тренировке прирост размера волокон может возрастать из-за умеренной скорости синтеза белка каждого из этих многих ядер, пропуская стадию добавления вновь образованных ядер. Это может способствовать относительной легкости переподготовки одним индивидуумам по сравнению с другими индивидуумами, которые начинают тренировку впервые.
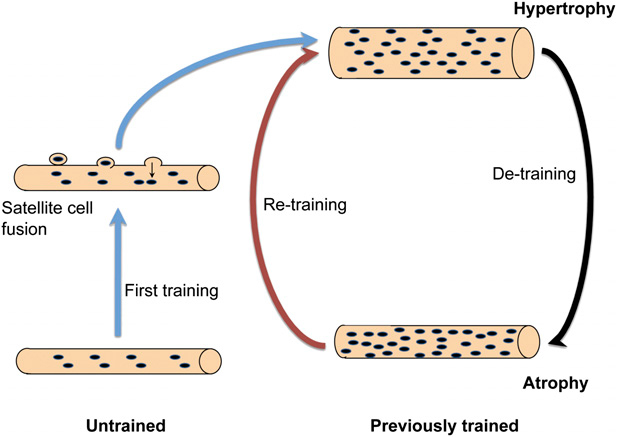
Рисунок 6.Модель, объясняющая зависимость между размером мышц и количеством миоядер.
В этой модели, миоядра являются постоянными. Ранее нетренированные мышцы приобретают вновь образованные ядра путем слияния клеток-сателлитов, предшествующих гипертрофии. После прекращения тренировки возникает атрофия, но миоядра не теряются. Увеличение количества ядер в мышечных волокнах, предшествующих гипертрофии является механизмом мышечной памяти, объясняя длительные последствия тренировки и легкость, с которой ранее тренированные лица легко снова достигают успехов в тренировке.
Гипотеза о том, что количество миоядер может устойчиво увеличиваться после эпизодической силовой тренировки может иметь последствия для населения, которое использует силовую тренировку для увеличения продолжительности жизни. Мышечная слабость у пожилых людей является серьезной проблемой здравоохранения (27, 28), и гипертрофия, индуцируемая перегрузкой значительно ослабляется у старых животных (29, 30). Количество миоядер может быть ограничивающим фактором (19). Показано, что активация клеток-сателлитов нарушается у пожилых людей (31). Вероятно, это связано с сокращением Notch-сигнализации между клетками (32, 33). Наши результаты показывают, что может быть выгодно «завалить» мышечные волокна ядрами посредством упражнений перед старением. Как было показано, анаболические стероиды увеличивают количество ядер (34, 35), таким образом, выгода от использования стероидов может быть постоянной, если, однако, не считать это как допинг-преступление.
Источником вновь приобретенных ядер во время «начала тренировки» скорее всего, являются клетки-сателлиты (36-38). Наш подход позволил выяснить, что наиболее интенсивный прирост происходит в течение 6-9 дней после введения перегрузки, и это согласуется с предыдущими наблюдениями о том, что гипертрофические стимулы инициируют митоз клеток-сателлитов до этого периода времени (39-41). Увеличение общего белкового синтеза (как и деградации белка) уже было обнаружено через несколько часов после введения гипертрофических стимулов (42-45), в том числе путем моделей гипертрофии, подобных нашей (46, 47). Именно это привело к предположению, что увеличение объема связано с увеличением синтетической способности ядер. И это предшествует появлению дополнительных ядер. В наших экспериментах, размер миоядерного домена был снижен во время фазы роста и остается пониженным, по крайней мере, в течение 12 дней. Даже если предположить, что синтез белка в ядре повышается во время ранней гипертрофии, этот механизм не является основным фактором увеличения размера мышечного волокна. Наши результаты показывают, что увеличение количества ядер является основной причиной гипертрофии.
Они, однако, не исключают, что гипертрофия, может возникать без добавления вновь образованных ядер, например, в экспериментальных условиях, в которых клетки-сателлиты уничтожаются, то есть в таких, как обсуждались недавно (48-59).
Alway с коллегами (23) проведен эксперимент, аналогичный нашему, когда они изучали влияние разгрузки на ранее перегруженные мышцы перепелов. Объединив BrdU окрашивание и окрашивание TUNEL, они показали, что ядра мышечной ткани, перенесшие митоз во время гипертрофии были особенно склонны к апоптозу. На основе этого наблюдения они предположили, что гипертрофия вызывает другую и менее стабильную популяцию миоядер. Этот вывод, кажется, находится в противоречии с нашими выводами, но в большинстве их экспериментов, не было сделано никаких различий между миоядрами и другими ядрами в мышечных тканях. Был приведен только один пример апоптоза ядра внутри коркового слоя дистрофина, не сообщалось также о частоте апоптоза в идентифицированных более доступных миоядрах. В дополнении к настоящему исследованию по отсутствию тренировки, несколько исследований по атрофии теперь не смогут продемонстрировать потерю ядер или миоядерного апоптоз (22, 60, 61). Учитывая методологические ограничения результатов, полученных посредством обычных гистологических методов (61), в настоящее время нет убедительных доказательств того, что из интактных мышечных волокон никогда не были потеряны ядра.
МАТЕРИАЛЫи МЕТОДЫ
Эксперименты на животных. Исследования проводились в Морском медицинском научно-исследовательском институте (NMRI). Были исследованы самки мышей весом 20-30 г. Эти данные представлены на рисунке 5. В остальных случаях изучались самцы крыс весом 270-370 г. Эксперименты на животных были утверждены были проведены в соответствии с Норвежским законом о защите животных от 20 декабря 1975 года.
Далее идет подробное описание всех экспериментальных методик: обезболивания, перегрузки, денервации, окрашивания и т.д).
Статистика. Эффекты отсутствия тренировки на популяцию ядер были протестированы ANOVA и теста Бонферрони для множественных сравнений. Числа даны как среднее ± SEM, если не указано иное.
Благодарности Мы благодарны членам нашей группы за ценные замечания по рукописи и T.К. Larsen по оказанию технической помощи. Это исследование было поддержано Норвежскими грантами 191730 и 182 717 исследований Совета и антидопинговой Норвегии.
Электронная почта: kgunder@imbv.uio.no
Эта статья представляет собой PNAS прямого подчинения. Свободно доступна в Интернете через опцию открытого доступа PNAS.
REFERENCES
- Staron RS, et al. (1991) Strength and skeletal muscle adaptations in heavy-resistance-trained women after detraining and retraining. J Appl. Physiol 70:631–640. Abstract/FREE Full Text
- Taaffe DR, Marcus R (1997) Dynamic muscle strength alterations to detraining and retraining in elderly men. Clin Physiol 17:311–324. Medline Web of Science
- Rutherford OM, Jones DA (1986) The role of learning and coordination in strength training. Eur J Appl Physiol Occup Physiol 55:100–105. Medline Web of Science
- MacDougall JD, Elder GC, Sale DG, Moroz JR, Sutton JR (1980) Effects of strength training and immobilization on human muscle fibres. Eur J Appl Physiol Occup Physiol 43:25–34. CrossRef Medline Web of Science
- Houston ME, Froese EA, Valeriote SP, Green HJ, Ranney DA (1983) Muscle performance, morphology and metabolic capacity during strength training and detraining: A one leg model. Eur J Appl Physiol Occup Physiol 51:25–35. CrossRef Medline Web of Science
- Ivey FM, et al. (2000) Effects of strength training and detraining on muscle quality: Age and gender comparisons. J Gerontol A Biol Sci Med Sci 55:B152–B157, discussion B158–B159. Abstract/FREE Full Text
- Smith K, Winegard K, Hicks AL, McCartney N (2003) Two years of resistance training in older men and women: The effects of three years of detraining on the retention of dynamic strength. Can J Appl Physiol 28:462–474. Medline Web of Science
- Harris C, DeBeliso M, Adams KJ, Irmischer BS, Spitzer Gibson TA (2007) Detraining in the older adult: Effects of prior training intensity on strength retention. J Strength Cond Res 21:813–818. CrossRef Medline Web of Science
- Strassburger E (1893) Ûber die Wirkungssphäre der kerne und die zellgrösse. Histologische Beiträge 5:97–124. Search Google Scholar
- Cavalier-Smith T (1978) Nuclear volume control by nucleoskeletal DNA, selection for cell volume and cell growth rate, and the solution of the DNA C-value paradox. J Cell Sci 34:247–278. Abstract
- Cavalier-Smith T (1980) How selfish is DNA? Nature 285:617–618. CrossRef Medline
- Merlie JP, Sanes JR (1985) Concentration of acetylcholine receptor mRNA in synaptic regions of adult muscle fibres. Nature 317:66–68. CrossRef Medline
- Hall ZW, Ralston E (1989) Nuclear domains in muscle cells. Cell 59:771–772. CrossRef Medline Web of Science
- Sanes JR, et al. (1991) Selective expression of an acetylcholine receptor-lacZ transgene in synaptic nuclei of adult muscle fibres. Development 113:1181–1191. Abstract
- Ralston E, Hall ZW (1992) Restricted distribution of mRNA produced from a single nucleus in hybrid myotubes. J Cell Biol 119:1063–1068. Abstract/FREE Full Text
- Gundersen K, Sanes JR, Merlie JP (1993) Neural regulation of muscle acetylcholine receptor epsilon- and alpha-subunit gene promoters in transgenic mice. J Cell Biol 123:1535–1544. Abstract/FREE Full Text
- Gregory TR (2001) Coincidence, coevolution, or causation? DNA content, cell size, and the C-value enigma. Biol Rev Camb Philos Soc 76:65–101. Medline
- Bruusgaard JC, Liestøl K, Ekmark M, Kollstad K, Gundersen K (2003) Number and spatial distribution of nuclei in the muscle fibres of normal mice studied in vivo. J Physiol 551:467–478. Abstract/FREE Full Text
- Bruusgaard JC, Liestøl K, Gundersen K (2006) Distribution of myonuclei and microtubules in live muscle fibers of young, middle-aged, and old mice. J Appl Physiol 100:2024–2030. Abstract/FREE Full Text
- Alway SE, Siu PM (2008) Nuclear apoptosis contributes to sarcopenia. Exerc Sport Sci Rev 36:51–57. Medline Web of Science
- Siu PM, Alway SE (2009) Response and adaptation of skeletal muscle to denervation stress: The role of apoptosis in muscle loss. Front Biosci 14:432–452. Medline Web of Science
- Bruusgaard JC, Gundersen K (2008) In vivo time-lapse microscopy reveals no loss of murine myonuclei during weeks of muscle atrophy. J Clin Invest 118:1450–1457. CrossRef Medline Web of Science
- Siu PM, Pistilli EE, Butler DC, Alway SE (2005) Aging influences cellular and molecular responses of apoptosis to skeletal muscle unloading. Am J Physiol Cell Physiol 288:C338–C349. Abstract/FREE Full Text
- Saraste A, Pulkki K (2000) Morphologic and biochemical hallmarks of apoptosis. Cardiovasc Res 45:528–537. Abstract/FREE Full Text
- Rosenblatt JD, Parry DJ (1992) Gamma irradiation prevents compensatory hypertrophy of overloaded mouse extensor digitorum lon Saraste A, Pulkki K (2000) Morphologic and biochemical hallmarks of apoptosis. Cardiovasc Res 45:528gus muscle. J Appl Physiol 73:2538–2543. Abstract/FREE Full Text
- S/li Alway SE, Siu PM (2008) Nuclear apoptosis contributes to sarcopenia. Exerc Sport Sci Rev 36:51eiden D (1976) Quantitative analysis of muscle cell changes in compensatory hypertrophy and work-induced hypertrophy. Am J Anat 145:459–465. CrossRef Medline Web of Science
- Hughes SM, Schiaffino S (1999) Control of muscle fibre size: A crucial factor in ageing. Acta Physiol Scand 167:307–312. CrossRef Medline Web of Science
- Dutta C, Hadley EC (1995) The significance of sarcopenia in old age. J Gerontol A Biol Sci Med Sci 50(Spec No):1–4. Web of Science
- Carson JA, nbsp;Yamaguchi M, Alway SE (1995) Hypertrophy and proliferation of skeletal muscle fibers from aged quail. J Appl Physiol 78:293–299. Abstract/FREE Full Text
- Alway SE, Degens H, Krishnamurthy G, Smith CA (2002) Potential role for Id myogenic repressors in apoptosis and attenuationli style="text-align: justify;" of hypertrophy in muscles of aged rats. Am J Physiol Cell Physiol 283:C66–C76. Abstract/FREE Full Text
- Schultz E, Lipton BH (1982) Skeletal muscle satellite cells: Changes in proliferation potentnbsp; Merlie JP, Sanes JR (1985) Concentration of acetylcholine receptor mRNA in synaptic regions of adult muscle fibres. Nature 317:66ial as a function of age. Mech Ageing Dev 20:377–383. CrossRef Medline Web of Science
- Conboy IM, Conboy MJ, Smythe GM, Rando TA (2003) Notch-mediated restoration of regenerative potential to aged muscle. Science 302:1575–1577. Abstract/FREE Full Text
- Conboy IM, Rando TA (2005) Aging, stem cells and tissue regeneration: Lessons from muscle. Cell Cycle 4:407–410. Medline Web of Science
- Kadi F, Eriksson A, Holmner S, Thornell LE (1999) Effects of anabolic steroids on the muscle cells of strength-trained athletes. Med Sci Sports Exerc 31:1528–1534. Medline Web of Science
- Sinha-Hikim I, et al. (2002) Testosterone-induced increase in muscle size in healthy young men is associated with muscle fiber hypertrophy. Am J Physiol Endocrinol Metab 283:E154–E164. Abstract/FREE Full Text
- Moss FP, Leblond CP (1970) Nature of dividing nuclei in skeletal muscle of growing rats. J Cell Biol 44:459–462. FREE Full Text
- Lipton BH, Schultz E (1979) Developmental fate of skeletal muscle satellite cells. Science 205:1292–1294. Abstract/FREE Full Text
- Schiaffino S, Bormioli SP, Aloisi M (1976) The fate of newly formed satellite cells during compensatory muscle hypertrophy. Virchows Arch B Cell Pathol Incl Mol Pathol 21:113–118. Medline Web of Science
- Schiaffino S, Bormioli SP, Aloisi M (1972) Cell proliferation in rat skeletal muscle during early stages of compensatory hypertrophy. Virchows Arch B Cell Pathol Incl Mol Pathol 11:268–273. Medline
- Winchester PK, Davis ME, Alway SE, Gonyea WJ (1991) Satellite cell activation in the stretch-enlarged anterior latissimus dorsi muscle of the adult quail. Am J Physiol 260:C206–C212. Medline Web of Science
- Snow MH (1990) Satellite cell response in rat soleus muscle undergoing hypertrophy due to surgical ablation of synergists. Anat Rec 227:437–446. CrossRef Medline
- Smith RH, Palmer RM, Reeds PJ (1983) Protein synthesis in isolated rabbit forelimb muscles. The possible role of metabolites of arachidonic acid in the response to intermittent stretching. Biochem J 214:153–161. Medline Web of Science
- MacDougall JD, et al. (1995) The time course for elevated muscle protein synthesis following heavy resistance exercise. Can J Appl Physiol 20:480–486. Medline
- Goldspink DF, et al. (1995) Muscle growth in response to mechanical stimuli. Am J Physiol 268:E288–E297. Medline Web of Science
- Chen YW, et al. (2002) Response of rat muscle to acute resistance exercise defined by transcriptional and translational profiling. J Physiol 545:27–41. Abstract/FREE Full Text
- Laurent GJ, Sparrow MP, Millward DJ (1978) Turnover of muscle protein in the fowl. Changes in rates of protein synthesis and breakdown during hypertrophy of the anterior and posterior latissimus dorsi muscles. Biochem J 176:407–417. Medline Web of Science
- Goldspink DF, Garlick PJ, McNurlan MA (1983) Protein turnover measured in vivo and in vitro in muscles undergoing compensatory growth and subsequent denervation atrophy. Biochem J 210:89–98. Medline Web of Science
- O’Connor RS, Pavlath GK (2007) Point:Counterpoint: Satellite cell addition is/is not obligatory for skeletal muscle hypertrophy. J Appl Physiol 103:1099–1100. FREE Full Text
- McCarthy JJ, Esser KA (2007) Counterpoint: Satellite cell addition is not obligatory for skeletal muscle hypertrophy. J Appl Physiol 103:1100–1102, discussion 1102–1103. FREE Full Text
- O’Connor RS, Pavlath GK (2007) In response to Point:Counterpoint: Satellite cell addition is/is not obligatory for skeletal muscle hypertrophy. J Appl Physiol 103:1102. FREE Full Text
- McCarthy JJ, Esser KA (2007) In response to Point:Counterpoint: Satellite cell addition is/is not obligatory for skeletal muscle hypertrophy. J Appl Physiol 103:1103. FREE Full Text
- Mantilla CB, Sieck GC (2007) In response to Point:Counterpoint: Satellite cell addition is/is not obligatory for skeletal muscle hypertrophy. J Appl Physiol 103:1104, (lett). FREE Full Text
- Rehfeldt C (2007) In response to Point:Counterpoint: Satellite cell addition is/is not obligatory for skeletal muscle hypertrophy. J Appl Physiol 103:1104, (lett). FREE Full Text
- Hikida RS (2007) In response to Point:Counterpoint: Satellite cell addition is/is not obligatory for skeletal muscle hypertrophy. J Appl Physiol 103:1104–1105, (lett). FREE Full Text
- Booth FW (2007) In response to Point:Counterpoint: Satellite cell addition is/is not obligatory for skeletal muscle hypertrophy. J Appl Physiol 103:1105, (lett). Medline Web of Science
- Kadi F (2007) In response to Point:Counterpoint: Satellite cell addition is/is not obligatory for skeletal muscle hypertrophy. J Appl Physiol 103:1105, (lett). Medline Web of Science
- Bodine SC (2007) In response to Point:Counterpoint: Satellite cell addition is/is not obligatory for skeletal muscle hypertrophy. J Appl Physiol 103:1105–1106, (lett). Medline Web of Science
- Lowe DA (2007) In response to Point:Counterpoint: Satellite cell addition is/is not obligatory for skeletal muscle hypertrophy. J Appl Physiol 103:1106, (lett). Medline Web of Science
- O’Connor RS, Pavlath GK, McCarthy JJ, Esser KA (2007) Last Word on Point:Counterpoint: Satellite cell addition is/is not obligatory for skeletal muscle hypertrophy. J Appl Physiol 103:1107, (lett). FREE Full Text
- Wada KI, Takahashi H, Katsuta S, Soya H (2002) No decrease in myonuclear number after long-term denervation in mature mice. Am J Physiol Cell Physiol 283:C484–C488. Abstract/FREE Full Text
- Gundersen K, Bruusgaard JC (2008) Nuclear domains during muscle atrophy: Nuclei lost or paradigm lost? J Physiol 586:2675–2681. Abstract/FREE Full Text
- Lichtman JW, Magrassi L, Purves D (1987) Visualization of neuromuscular junctions over periods of several months in living mice. J Neurosci 7:1215–1222. Abstract
- Utvik JK, Njå A, Gundersen K (1999) DNA injection into single cells of intact mice. Hum Gene Ther 10:291–300. CrossRef Medline Web of Science
- Wada KI, Katsuta S, Soya H (2003) Natural occurrence of myofiber cytoplasmic enlargement accompanied by decrease in myonuclear number. Jpn J Physiol 53:145–150. CrossRef Medline Web of Science
Перевод А.В.Самсоновой