ХИМИЧЕСКАЯ КИНЕТИКА -
- изучает механизм протекания процесса, т.е. промежуточные стадии, через которые система переходит из начального в конечное состояние, скорости этих стадий, факторы, влияющие на их скорость.
Скорость реакции -
|
 ;
; 
V – объём реакционной зоны;
S - поверхность раздела фаз;  - время
- время
n i – количество i – го исходного вещества.
Если V=const во время реакции: 



 - для исходных веществ - отрицательна Þ
- для исходных веществ - отрицательна Þ 
 -для продуктов – положительная Þ
-для продуктов – положительная Þ 
Cкорость реакции зависит от:
1)природы реагирующих веществ,
2)концентрации или давления реагирующих веществ,
3)температуры
4)катализатора
Влияние концентрации на скорость реакции
По теории вероятностей: вероятность одновременного осуществления независимых событий равна произведению вероятностей каждого из них.
Для протекания реакции: A+B→ K +L
необходимо:
· одновременное нахождение А и В в определённой точке реакционного пространства;
· удачное их столкновение.
Вероятность (ω) нахождения молекулы для каждого из веществ прямо пропорциональна его концентрации:
ω A = α×Cа A, ω B = β×C в B.
Вероятность одновременного нахождения обеих молекул в одной точке пространства, т.е. их столкновения:
ω = ω A × ω B = α×Cа A × β×Cв B.
γ – доля удачных столкновений



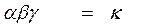
|

 -основное кинетическое уравнение, закон действия масс, закон Гульдберга Вааге (1864г).
-основное кинетическое уравнение, закон действия масс, закон Гульдберга Вааге (1864г).

k - константа скорости: а) не зависит от концентрации
б) зависит от температуры и природы реагирующих веществ.
k – удельная скорость Þ  , если СА = С В
, если СА = С В
а,в – частные порядки реакции по веществам А и В
(определяются экспериментально)
n = (а + в) – общий порядок реакции
В простых (элементарных актах) реакциях: n = 1, 2 редко 3.
В сложных реакциях: n = 0, целочисленные, дробные, (-),(+)
Молекулярность:
|
Целое (+) число: 1,2, реже 3
1 – мономолекулярные: I2 ® 2I
2 – бимолекулярные: H2 + I2 ® 2HI
3 – тримолекулярные: 2NO + Cl2 ® 2NOCl
а) H2 + I2 ® 2HI – простая (элементарная) реакция
n (Н2) = 1, n (I2) =1,т.е. равны стехиометрическим коэффициентам.
n = 1+1 =2 Þ 
б) 2N2O5 ® O2 + 2N2 O4 - сложная реакция
протекает по стадиям:
- N2O5 ® NO2 + NO3;
- NO3 ® NO + NO2;
- NO + NO3 ® 2NO2.
и самая медленная стадия – (2) Þ она определяет порядок
кинетического уравнения:

 Опыт: 5Na2SO3 + 2HJO3
Опыт: 5Na2SO3 + 2HJO3  J2 + 5Na2SO4 + H2O
J2 + 5Na2SO4 + H2O
 ;
;  ;
; 

 ; (x+y) lg 1,4 = lg 2; x+y =
; (x+y) lg 1,4 = lg 2; x+y =  @ 2
@ 2
 Лаб.раб.: Na2S2O3 +H2SO4 = S + H2SO3 + Na2SO4
Лаб.раб.: Na2S2O3 +H2SO4 = S + H2SO3 + Na2SO4
Реакции 1-ого порядка
 А В CH3OCH3® CH4 + H2 + CO
А В CH3OCH3® CH4 + H2 + CO
Кинетическое уравнение реакции первого порядка
 .
.
Разделим переменные и проинтегрируем

lnC – lnC0 = -kt Þ lnC = lnC0 - kt
С0 – исходная концентрация
С - концентрация в момент времени t

Кинетическая кривая реакций 1-ого порядка
 lg C
lg C
lg C o tga = - 
a
t, с
 или
или  . [ k ] = [с-1]
. [ k ] = [с-1]
 .
.
период полупревращения τ1/2:
|
C = 0,5C0 Þ 
 - не зависит от С о
- не зависит от С о
Реакции 2-ого порядка
A + B → продукты или 2А ® продукты

пусть C0 A = C0 B

разделим переменные и проинтегрируем:


 [л×моль-1×с-1]
[л×моль-1×с-1]
Кинетическая кривая реакций 2-ого порядка

 1/C
1/C
a tga = k
1/C0
t
Период полупревращения для реакций 2-ого порядка
C = ½ C0


t ½ - обратно пропорционально начальной С0
Реакции 0-ого – порядка: С = С0 - kt; t1/2 = С0 /2k
Реакции 3-его порядка: 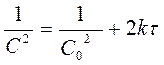 ;
; 
