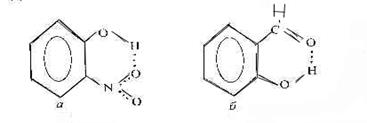
о-нитрофенол (а) салициловый альдегид (б)
 |
Е(н-связи) возрастает с увеличением ЭО и уменьшением размеров атомов В:
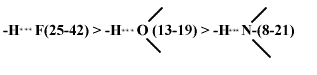 |
Несмотря на высокую ЭО, у хлора Н- связь – Н…Сl- относительно слабая из-за большого размера атома хлора.
Энергия водородной связи имеет промежуточное значение между энергией ковалентной связи и вандерваальсовых сил.
У воды длина связи О–Н – 0,096 нм, а связи О…Н – 0,177 нм.
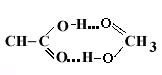 |
Возникновение водородных связей приводит к образованию димеров, тримеров и других полимерных структур, например, зигзагообразных структур (НF)n, кольцевой димерной структуры низших карбоновых кислот:
Межмолекулярные Н-связи изменяют свойства веществ: повышают вязкость, диэлектрическую постоянную, температуру кипения и плавления, теплоту плавления и парообразования.
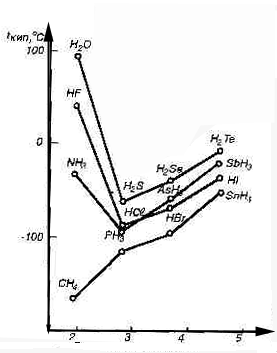 |
Н2О, НF и NН3 - аномально высокие Ткип и Тпл.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Вещества, в которых элементы проявляют «дополнительные» валентности рассматриваются как соединения высшего порядка и называются комплексными: [Ag(NH3)2]Cl; Na3[Al(OH)6].
катион – [Аg(NH3)2]+, анион – [Al(OH)6]3 - комплексные ионы – устойчивы и существуют самостоятельно как в растворах так и в узлах кристаллической решетки.

 Структура комплексных соединений
Структура комплексных соединений
координационная внешняя сфера
 |
(внутренняя) сфера

 Внутренняя сфера (комплекс)
Внутренняя сфера (комплекс)
Комплексообразователь лиганды
( центральный атом) (адденты)
Координационное число:
|
[Аg(NH3)2]+ [Al(OH)6]3-
Аg+, Аl3+ - комплексообразователи;
NН3, ОН- - лиганды;
2;6 – координационные числа.
Дентатность лиганда
|
моно-, би-, полидентатные лиганды, например:
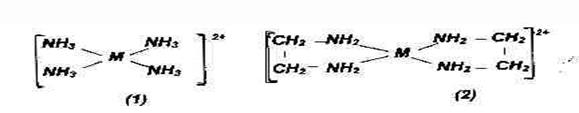 |
лиганд NH3 – монодентатный
лиганд -NH2–СН2–СН2 – NH2- – бидентатный
лиганд (-NCS)- - амбидентатный - лиганды, которые могут координироваться различными своими атомами [V(-NCS)6]3- [Нg(-SCN)]
Заряд комплекса:
|
[Zn(CN)4]?
Z = Z(Zn+2) + 4Z (CN-) = 2+4(-1) = -2 Þ[Zn(CN)4]2-
Химическая связь в комплексных соединениях Внешняя сфера удерживается около внутренней сферы за счет электростатического ион-ионного взаимодействия.
Используют несколько квантово-механических подходов: метод ВС, теория поля лигандов и метод МО.
Теория валентных связей (ВС).
Для комплексов, у которых в качестве комплексообразователя выступают s-,p- или d 10 –элементы.
Между комплексообразователем и лигандами возникают ковалентные связи, образованные по донорно-акцепторному механизму.
донор – лиганд (поставщика пары электронов) акцептор – комплексообразователь
(наличие свободных АО)
Все вакантные орбитали комплексообразователя, принимающие участие в образовании связи одинаковы по энергии и по форме т.е. они гибридизованы.
Комплекс [AlBr4]-
Атом Аl …3 s 23 р 1
комплексообразователь Al3+:



 3 s 03 p 0
3 s 03 p 0



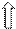
:Br-:Br-:Br-:Br-
 |
 : Br-
: Br-
неподеленные пары электронов лигандов
sp 3-гибридизация орбиталей.
Строение комплексного иона - тетраэдр