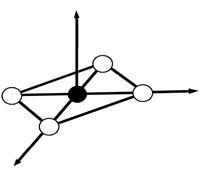
орбитали лигандов, внедряясь в электронную оболочку комплексообразователя, оказывают влияние на состояние электронов на d - орбиталях.
Неспаренные электроны, испытывая отталкивание от электронных пар лигандов, могут спариваться, переходя на более дальние от лигандов d- орбитали центрального атома.
Сильное поле лиганда
|
в противном случае - лиганд слабого поля.
Для 3 d -элементов - спектрохимический ряд лигандов
(в порядке возрастания силы поля):
I-< Br-<SCN- <Cl-< F- <ОН- <ONO- <H2O< NCS-< NH3< < NO2-< NC-< CO
Но границы между сильным и слабым полями лигандов провести сложно.
[MnF6]2- лиганд F- - слабое поле,
[NiF6]2- лиганд F- - сильное поле.
Комплекс Fe(CN)6]3-
Комплексообразователь Fe3+: 3 d 54 s 0.
Лиганды CN- - лиганды сильного поля,
|









Fe+3
3 d 4 s 4 p
d2sp3 -гибридизация орбиталей
структура комплекса - октаэдр.
Теория кристаллического поля.
Комплексообразователь – d 1-9 элемент
1. Лиганды располагаются вокруг комплексообразователя так, чтобы силы притяжения были максимальны, а силы отталкивания минимальны.
2. Лиганды влияют на энергетическое состояние d- электронов комплексообразователя.
В отсутствии внешнего электростатического поля все d -орбитали - вырожденные.
Под воздействием поля лигандов Þ расщепление d- подуровня на величину D, называемую энергией расщепления.
D - зависит от к.ч., природы лигандов и комплексообразователя.
плоский квадрат 
октаэдр
тетраэдр
de dg
Dтетр Dокт Dквадр.пл.
dg (n- 1) d -орбитали de
свободного иона
комплексообразователя
Если Еспаривания < Ерасщепления Þспаривание электронов Þ низкоспиновые комплексы.
В противном случае комплекс- высокоспиновый.
Ерасщепления(4d,5d) > Ерасщепления(3d) Þ для комплексообразователей 4d,5d-элементов Þ все лиганды сильного поля.
Координационное число 6
октаэдрическое расщепление (n -1) d - орбиталей:
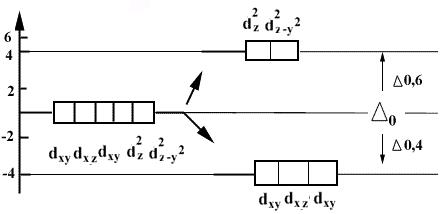 |
Распределение электронов на (n -1) d -орбиталях:
 |
(зависит от силы поля лиганда)
В образовании химической связи участвуют:
(n -1) d g-, n s -, n p - и n d - орбитали.
Комплекс [Co(Н2О)6]2+.
комплексообразовательСо2+: 3 d 74 s 0.
К.ч. 6 Þ октаэдрическое расщепление.
центральный атом – 3 d – элемент Þсила поля лиганда по спектрохимическому ряду.
Н2О – лиганд среднего поля, а для Со2+ (низшая степень окисления) он относится к слабым.
Энергетическая диаграмма расщепления d -подуровня
: н2о: н2о: н2о: н2: н2о: н2о
















 Е
Е

3 dg 4 s 4 p 4 d
 |







 3 de
3 de
sp 3 d 2-гибридизация
структура комплекса [Со(Н2О)6]2+ - октаэдр
Комплекс – высокоспиновый, внешнеорбитальный, т.к. взаимодействует внешний d - подуровень.
Высокоспиновые комплексы менее прочные, чем низкоспиновые,
Магнитные свойства комплекса определяются числом неспаренных электронов на (n-1) d e,g - орбиталях.
Если на (n-1) d e,g - орбиталях имеются неспаренные электроны, комплекс - парамагнетик (слабые магнитные свойства)
Если на (n -1) dg,e – орбиталях нет неспаренных электронов, комплекс - диамагнетик (нет магнитных свойств)
[Со(Н2О)6]2+ -парамагнетик
комплекса [PtВr6]2-
комплексообразователь Pt4+: 5 d 66 s 0 Комплексообразователь 5 d - элемент Þ лиганды сильного поля
К.ч. 6 Þ октаэдрическое расщепление 5 d - орбиталей.
Энергетическая диаграмма:
Е:Br-:Br- :Br- :Br- :Br-:Br-

5 dg 6 s 6 p
5 d 5 de

d2sp3 – гибридизация
структура комплекса - октаэдр
комплекс - внутриорбитальный, устойчивый,т.к. участвуют внутренние 5dg-орбитали
комплекс - низкоспиновый, диамагнетик, т.к. нет неспаренных электронов.
Координационное число 4
1.Если комплексообразователь 3 d – элемент Þ лиганды слабого поля Þ тетраэдрическое расщепление.
2. Если комплексообразователь 4 d - или 5 d - элементы Þ лиганды сильного поля Þ плоско-квадратное расщепление.
| К.ч. | компл- обр-ль | лиганды | Гибридизация орбиталей | Структура комплекса |
| любой | sp | линейная | ||
| 3 d -элемент | Все слабого поля | d3s, d2sp, sp3 | тетраэдр | |
| 4 d, 5 d -элемент | Все сильного поля | dsp2 | Плоский квадрат | |
| любой | d2sp3, sp3d2, dsp3d | октаэдр |
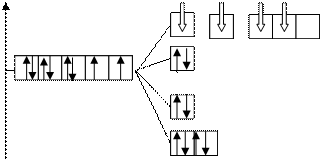
комплекс [Au(NH3)4]3+
Комплексообразователь Au3+: 5 d 86 s 0.
К.ч. 4
комплексообразователь 5 d - элементÞ лиганды сильного поля Þ плоско-квадратное расщепление
Энергетическая диаграмма:
|
 Е
Е
5 d
6s 6 p
dsp2 - гибридизации орбиталей
комплекс - низкоспиновый, диамагнетик (нет неспаренных электронов).
комплекса [NiCl4]2-
комплексообразователь Ni2+: 3 d8 4 s2
К.ч. 4
комплексообразователь - 3 d - элементам
лиганды Þ слабого поля
тетраэдрическое расщепление d - орбиталей
Энергетическая диаграмма:

 : Cl: Cl: Cl: Cl
: Cl: Cl: Cl: Cl
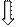





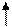








 Е
Е
 3 de
3 de












 4 s 4 p
4 s 4 p




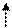


 3 dg
3 dg
sp 3-гибридизация АО
структура - тетраэдр
комплекс - высокоспиновый, непрочный,
парамагнетик, т.к. есть неспаренные электроны на 3 de - орбиталях
ОКРАСКА КОМПЛЕКСОВ.
Т.К. разность энергии (D) между dg - и de -орбиталями небольшая, возможен переход электрона с более низкого на более высокий уровень энергии за счет поглощения видимого света. Этот переход является причиной определенной окраски комплекса,
т.е. окраска зависит от того, фотоны какой длины волны могут этим комплексом поглощаться.
При этом энергия кванта света должна быть точно равна энергии расщепления D, т.е. h×n=D. Зная длину волны света (l=c/n), соответствующую окраске комплекса, можно рассчитать для того или иного лиганда D=ch/l.
При замене в комплексе одних лигандов на другие, расположенные в спектрохимическом ряду левее (т. е. обладающие большей силой поля), значение D возрастает, и комплекс начинает поглощать лучи света с меньшей длиной волны. Это сказывается на изменении его окраски. Например,
(Со(ONO)(NH3)5)2+- красный
(Co(NO2)(NH3)5)2+ - желтый.
(CuCl4)2- - зеленый
(Cu(H2O)4)2+ -голубой
(Cu(NH3)4)2+ -сине-фиолетовый
Для большинства двухзарядных комплексообразователей энергия расщепления
D отвечает n в пределах от 8000 до 14000 см-1, что соответствует энергии от 95 до 140 кДж/моль.
Видимый спектр имеет следующие длины волн (нм):
фиолетовый 400 – 420 желтый 575 – 585
голубой 424 – 490 оранжевый 585 – 647
зеленый 490 –575 красный 647 – 710
При поглощении веществом определенной части спектра само вещество является окрашенным в «дополнительный» цвет.
| Поглощение | фиолетовый | синий | голубой | сине-зелёный | зелёный |
| окраска вещества | зелёно-желтый | желтый | оранжевый | красный | пурпурный |