ФИЗИКА
Определение отношения теплоемкости воздуха при постоянном давлении и постоянном объеме
Методические указания
к выполнению лабораторной работы №10
для студентов очной и очно-заочной форм обучения
технических специальностей
Брянск 2010
УДК 530
Физика. Определение отношения теплоемкости воздуха при постоянном давлении и постоянном объеме: методические указания к выполнению лабораторной работы №10 для студентов очной и очно-заочной форм обучения технических специальностей. – Брянск: БГТУ, 2010. – 13 с.
Разработали:
А.А.Демидов,
канд. физ-мат. наук, доц.,
Е.А.Кульченков,
ст. преп.
Рекомендовано кафедрой “Общая физика"
(протокол № 1 от 25.01.10)
Лабораторная работа № 10
Определение отношения теплоемкости воздуха при постоянном давлении и постоянном объеме
Цель лабораторной работы – ознакомление с одним из методов определенияотношения теплоемкости воздуха при постоянном давлении С p к теплоемкости воздуха при постоянном объеме С v.
Оборудование: стеклянный сосуд, манометр, компрессор и секундомер.
Теоретическое введение
Способность любого тела изменять свою температуру при сообщении ему теплоты характеризуется теплоемкостью тела. Применительно к газам наиболее часто используется понятие молярной теплоемкости.
Молярная теплоемкость газа – это величина, численно равная количеству теплоты, необходимому для нагревания 1 моля газа на 1 К
 ,
, 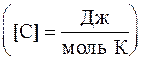 .
.
Из первого начала термодинамики вытекает, что теплоемкость газов зависит от условий нагревания, т.е. теплоемкость будет различной, если нагревать газ при постоянном объеме (С v) или при постоянном давлении (C p).
|
|
Действительно, если газ расширяется изобарически (при P = const), то согласно первому началу термодинамики
Q = D U + A, (1)
количество теплоты Q, полученное газом, расходуется на изменение его внутренней энергии U (U – суммарная, механическая энергия всех молекул газа, [ U ] = Дж) и на совершение работы А ([ А ] = Дж).
Если же процесс изохорический (при V = const), то работа
А = 0 и первый закон термодинамики примет вид:
Q = D U, (2)
т.е. тепло расходуется лишь на изменение внутренней энергии газа.
Если в обоих случаях температура изменилась на 1 К, то изменение внутренней энергии одинаково и из сравнения (1) и (2) очевидно, что при изобарическом процессе теплоемкость больше на величину совершенной работы А, т.е. С p > C v.
Для определения отношения теплоемкости при постоянном давлении С p к теплоемкости при постоянном объеме C v следует рассмотреть процесс, где это отношение играет существенную роль. Таким процессом является адиабатический процесс – процесс, происходящий при отсутствии теплообмена газа с окружающей средой. Адиабатический процесс описывается уравнением Пуассона:
 , (3)
, (3)
либо
 . (4)
. (4)
Здесь Р – давление газа ([ Р ] = Па), V - объем газа ([ V ] = м3)
и  (5) – показатель адиабаты. Для идеального газа показатель адиабаты будет равен
(5) – показатель адиабаты. Для идеального газа показатель адиабаты будет равен
 , (6)
, (6)
здесь i – количество степеней свободы молекулы рассматриваемого газа, т.е. число координат, необходимое и достаточное для описания положения молекулы в пространстве.
Из выражения (6) видно, что для определения отношения теплоемкостей необходимо вычислить g.
В реальных условиях добиться адиабатического процесса, т.е. осуществить полную теплоизоляцию, очень трудно. На практике пользуются тем фактом, что установление равновесного давления протекает очень быстро – за доли секунды, а на выравнивание температуры вследствие теплообмена газа с внешней средой требуются минуты. Следовательно, для осуществления процесса, близкого к адиабатическому, достаточно быстро изменить давление в газе.
|
|
Описание установки и метода измерения
Основным элементом лабораторной установки (рис. 1), позволяющей осуществить процесс, близкий к адиабатическому, необходимый для определения отношения теплоемкости, является стеклянный сосуд, в котором создается с помощью компрессора избыточное давление. Для определения избыточного давления служит U-образный жидкостный (вода) манометр. Расширение находящегося в сосуде газа происходит за счет сообщения сосуда с атмосферой путем нажатия и удержания в течение определенного времени рычага клапана.

Рис. 1. Лабораторная установка
После нагнетания компрессором воздуха в сосуде устанавливается некоторое давление P 1. Так как при сжатии воздух нагревается, то температура воздуха в баллоне после накачивания становится выше комнатной Т 0. Происходит изохорический процесс 0-1 (рис. 2) остывания воздуха при постоянном объеме. При этом давление воздуха в баллоне падает. Этот процесс сопровождается уменьшением разности уровней жидкости в коленах манометра. Стабилизация разности уровней жидкости в коленах манометра указывает на то, что температура воздуха в баллоне достигла комнатной температуры Т 0 (точка 1 на рис. 2). В результате в баллоне устанавливается давление, превышающее атмосферное давление Р 0 на величину Δ P, пропорциональную разности уровней жидкости в коленах манометра. При нажатии на рычаг клапана сосуд сообщается с атмосферой, и воздух адиабатически расширяется (процесс 1-2 на рис. 2). Выражение (4), описывающее этот процесс, сначала прологарифмируем, затем продифференцируем:
|
|
 . (7)
. (7)
Поскольку изменение давления и температуры воздуха в сосуде относительно атмосферного невелико, то величины dP и dT можно представить как конечные изменения давления D P и температуры D T:
 . (8)
. (8)

Рис. 2. График изопроцессов, реализующихся в ходе выполнения лабораторной работы
Для адиабаты (1-2) D P = P 0 - P 1; D T = T 1 - T 0. Тогда выражение (8) примет вид:
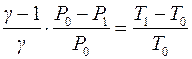 . (9)
. (9)
Как отмечалось, выравнивание давления при открытии сосуда происходит за доли секунды. Клапан же остается открытым в течение более длительного времени. За это время за счет теплообмена воздух будет нагреваться, что приведет к дальнейшему расширению (процесс 2-3 на рис. 2). Расширение будет изобарическим, так как давление остается равным атмосферному.
Количество теплоты dQ, переданное газу при изобарическом расширении, будет равно
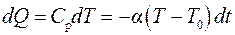 ,
,
где a – коэффициент теплопередачи, зависящий от свойств стенок сосуда, Т – температура воздуха в сосуде, Т 0 – температура среды, окружающей сосуд, т.е. комнатная, dt – время, в течение которого происходит изобарическое расширение газа.
Тогда получаем
 . (10)
. (10)
Так как при изобарическом расширении температура меняется от Т 1 до Т 2, то в результате интегрирования выражения (10) получим
 . (11)
. (11)
После закрытия клапана воздух в сосуде начнет изохорически нагреваться за счет теплообмена через стенки сосуда (процесс 3-4 на рис. 2). Полагая в уравнении Менделеева-Клапейрона
 (12)
(12)
V = const, прологарифмируем и продифференцируем его,
получим:  или, если принять конечные величины изменения давления и температуры
или, если принять конечные величины изменения давления и температуры
 . (13)
. (13)
Для изохоры (3-4) D P = P 2 - P 0, D T = T 0 – T 2, и
 . (14)
. (14)
Разделив уравнение (9) на (14), получим
 .
.
Разность давлений (Р 1 - Р 0) и (Р 2 - Р 0) измеряется жидкостным манометром и поэтому может быть выражена через разность уровней жидкости в коленах манометра D Н (разность уровней жидкости в коленах манометра до открытия клапана) и D h (разность уровней жидкости в коленах манометра через время t после закрытия клапана). С учетом этого
 . (15)
. (15)
Подставим выражение (15) в (11):
 . (16)
. (16)
Из выражения (16) видно, что  является линейной функцией от времени t. Вид этой функции представлен на рис. 3. Причем, при t = 0
является линейной функцией от времени t. Вид этой функции представлен на рис. 3. Причем, при t = 0
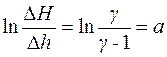 . (17)
. (17)
Из рис. 3 видно, что а – отрезок, отсекаемый при экстраполяции полученной зависимости на оси абсцисс. Из (17) получаем, что
 . (18)
. (18)
Выражение (18) содержит в качестве единственного параметра величину а, которая может быть определена графически. Таким образом, определение отношения теплоемкостей C p и C v сводится к построению графика  .
.

Рис. 3. Зависимость 
Техника безопаСности
1. Соблюдайте общие правила техники безопасности при использовании электрических приборов.
2. Не загромождайте рабочее место посторонними предметами и будьте аккуратны со стеклянным сосудом.
3. При нажатии кнопки включения компрессора будьте внимательны и не допустите выливания жидкости из манометра.
4. По завершении работы не забудьте отключить секундомер от сети и обесточить всю установку.