Фенолы.
Фенолы - производные ароматических УВ, в молекулах которых гидроксильная группа (- ОН) непосредственно связана с атомами углерода в бензольном кольце.


Фенол C6H5OH –молекулярная формула.
Классификация фенолов
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:
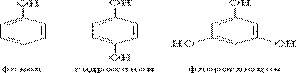
Гидроксибензол 1,4 –дигидроксибензол
Пара-дигидроксибензол
Фенол – тривиальное название, которое принято и в номенклатуре ИЮПАК. Многие фенолы сохраняют тривиальные названия:

Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
Химические свойства Фенола.
 Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга
Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга
Бензольное кольцо влияет на свободу водорода гидроксогруппы.
Неподеленная электронная пара кислорода притягивается пи-электронным облаком бензольного кольца, из – за чего, связь О–Н еще сильнее поляризуется. Фенол - более сильная кислота, чем вода и спирты.
Гидроксогруппа влияет на свободу водородов в бензольном кольце.
В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2, 4, 6. Это делает более реакционноспособными связи С-Н в положениях 2, 4, 6 и – связи бензольного кольца.
1.Кислотные свойства.Реакции, идущие с отщеплением катиона водорода в гидроксогруппе.
Кислотные свойства фенола выражены сильнее, чем у воды и у спиртов,
Что связано с бОльшей полярностью O—H связи.
В отличие от спиртов, фенолы реагируют не только с щелочными Ме:
(этанол+ натрий =этанолят натрия +водород
2С2Н5ОН + 2 Na = 2 C2H5ONa + H2), спирт+ щёлочь- не взаимодействуют
и щелочноземельными Ме, но и с растворами щелочей, образуя феноляты:
2C6H5OH + 2Na → 2C6H5ONa + H2
Фенол фенолят натрия
C6H5OH + NaОН → C6H5ONa + H2О
Фенол фенолят натрия
Поэтому и называется - карболовая кислота.
Фенол – это слабая кислота, даже угольная кислота более сильная, она может вытеснять фенол из фенолята натрия.
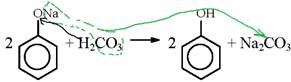
Фенолят растворим в воде, фенол не растворим, поэтому при пропускании углекислого газа через фенолят образуется мутный осадок фенола в воде.
Минеральные кислоты и подавно вытесняют фенол из фенолята.

Реакции, идущие по бензольному кольцу фенола. Наличие гидроксогруппы облегчает замещение водородов в радикале – фенил фенола.

Фенол легко вступает в реакцию с бромной водой. Качественная реакция на фенолы. Если прилить бромную воду к раствору фенола, то образуется белый осадок 2,4,6-трибромфенола.
-Нитрование. Два варианта нитрования. Под действием 20% азотной кислоты (разб.) HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов:

При использовании HNO3(конц.) образуется 2,4,6-тринитрофенол (пикриновая кислота):

-Гидрирование ароматического ядра фенола.
C6H5-OH + 3H2 Ni, 170ºC → C6H11 – OH циклогексиловый спирт (циклогексанол). 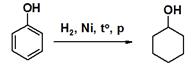
Ещё одна качественная реакция на фенолы.
Характерной реакцией фенола, по которой его можно обнаружить среди других веществ, реакция с раствором феррум (III) хлорида. Вследствие сливания растворов веществ образуется соединение фиолетового цвета.