Однокомпонентные системы
При изменении температуры T и давления p объем, занимаемый одним молем какого-либо вещества (молярный объем V), изменяется. Меняется и состояние вещества. Если один моль этого вещества занимает большой объем и молекулы вещества удалены друг от друга, то вещество находится в газообразном состоянии. При малых значениях молярного объема оно находится в конденсированном состоянии – жидком или твердом. Зная уравнение состояния для данного вещества, можно было бы вычислить величину молярного объема при любых заданных значениях температуры и давления.
Но уравнение состояния известно только для идеальных газов – это уравнение Менделеева-Клапейрона pV = RT. Для всех других случаев, когда собственным объемом частиц системы и силами взаимодействия между ними пренебрегать нельзя, величину молярного объема приходится определять экспериментально.

Трехмерная диаграмма состояния однокомпонентной системы (на примере СО2) представлена на рис 3.2. Так как зависимость между величинами T, p и V очень сложна, в этом случае не пользуются уравнениями состояния, а строят пространственную диаграмму зависимости V от p и T – диаграмму состояния.
Однако пространственные диаграммы не очень удобны для практического применения, и поэтому обычно пользуются не ими, а их проекциями на координатные плоскости – чаще всего на плоскость р-Т.
С помощью плоской диаграммы нельзя определить молярный объем вещества, но можно, пользуясь принципом соответствия, определить, в каком состоянии это вещество находится, при каких температурах и давлениях совершаются те или иные фазовые переходы и т. д. По виду таких диаграмм можно определить, существует ли данное вещество в твердом состоянии только в одной кристаллической форме или оно способно к полиморфизму, т.е. существованию в виде нескольких кристаллических форм модификаций). Полиморфизм простых кристаллических веществ также называют аллотропией
Вещества, образующие в твердом состоянии одну
Кристаллическую форму.
Рассмотрим однокомпонентную диаграмму состояния, т.е. когда компонент может существовать лишь в трех фазах (парообразной, жидкой и одной твердой) (рис.2.1). Эта плоская P - T - диаграмма делится кривыми на три области, в каждой из которых компонент может устойчиво существовать только в одной фазе: ниже кривой BОА - в парообразной, между кривыми ОA и ОС - в жидкой, левее кривой ОС и выше кривой ОB - в твердой. Кривые ОС, ОB и ОA отвечают условиям равновесного сосуществования двух фаз: твердой и жидкой (линия плавления ОС); твердой и парообразной (линия возгонки или сублимации ОB - теоретически продолжается до абсолютного нуля); жидкой и парообразной (линия испарения ОA). Пар, находящийся в равновесии с жидкостью или твердым телом, называется насыщенным. В области высоких температур линия испарения оканчивается в критической точке А (T кр = 607,46 К, Р = 19,5 МПа), в которой исчезает различие между жидкостью и паром. Критическая температура T крусловно делит область парообразного состояния вещества на две зоны: ниже T кр это состояние называется пар, а выше T кр - газ. Повышая давление, пар можно перевести в жидкость, а газ - невозможно.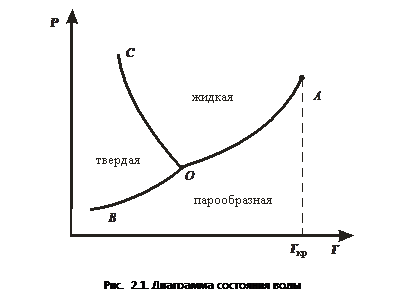 Все три линии: плавления, испарения и возгонки - сходятся в одной точке О, отвечающей равновесному сосуществованию трех фаз и поэтому называющейся тройной точкой. Число степеней свободы при любых значениях температуры T и давления Р определяется правилом фаз Гиббса (2.2). При K = 1 и n = 2 c = 3 – Ф. Согласно этому уравнению, если фигуративная точка, описывающая состояние однокомпонентной системы, расположена в одной из областей диаграммы, где Ф = 1, то система бивариантна (c = 2), т.е. можно произвольно изменять оба параметра - давление и температуру, не вызывая изменения числа фаз, находящихся в равновесии.Если фигуративная точка расположена на одной из линий ОA, ОB или ОС, где Ф = 2, то система моновариантна (c = 1), т.е. можно произвольно менять только один из параметров - давление или температуру (если изменяется температура, то давление будет изменяться в соответствии с ходом кривой, и наоборот). Отсюда следует, что давление насыщенного пара любого вещества зависит только от температуры и не зависит от количества вещества или его пара.Если состояние однокомпонентной системы описывается тройной точкой, т.е. отвечает равновесию между тремя фазами, (Ф = 3), то система нонварианта (инвариантна), т.е. в этой точке ни один из параметров не может быть изменен. Равновесное сосуществование трех фаз однокомпонентной системы возможно только при строго определенных значениях температуры и давления. Так, тройной точке воды отвечают температура 273,16 K (0,01 °C) и давление 6,09 ∙ 102 Па (0,00601 атм). Поскольку число степеней свободы не может быть отрицательной величиной, из уравнения c = 3 – Ф следует, что в однокомпонентных системах в равновесии может сосуществовать не более трех фаз.
Все три линии: плавления, испарения и возгонки - сходятся в одной точке О, отвечающей равновесному сосуществованию трех фаз и поэтому называющейся тройной точкой. Число степеней свободы при любых значениях температуры T и давления Р определяется правилом фаз Гиббса (2.2). При K = 1 и n = 2 c = 3 – Ф. Согласно этому уравнению, если фигуративная точка, описывающая состояние однокомпонентной системы, расположена в одной из областей диаграммы, где Ф = 1, то система бивариантна (c = 2), т.е. можно произвольно изменять оба параметра - давление и температуру, не вызывая изменения числа фаз, находящихся в равновесии.Если фигуративная точка расположена на одной из линий ОA, ОB или ОС, где Ф = 2, то система моновариантна (c = 1), т.е. можно произвольно менять только один из параметров - давление или температуру (если изменяется температура, то давление будет изменяться в соответствии с ходом кривой, и наоборот). Отсюда следует, что давление насыщенного пара любого вещества зависит только от температуры и не зависит от количества вещества или его пара.Если состояние однокомпонентной системы описывается тройной точкой, т.е. отвечает равновесию между тремя фазами, (Ф = 3), то система нонварианта (инвариантна), т.е. в этой точке ни один из параметров не может быть изменен. Равновесное сосуществование трех фаз однокомпонентной системы возможно только при строго определенных значениях температуры и давления. Так, тройной точке воды отвечают температура 273,16 K (0,01 °C) и давление 6,09 ∙ 102 Па (0,00601 атм). Поскольку число степеней свободы не может быть отрицательной величиной, из уравнения c = 3 – Ф следует, что в однокомпонентных системах в равновесии может сосуществовать не более трех фаз. Внутри каждой из областей диаграммы система однофазна; число степеней свободы системы равно двум (система дивариантна), т.е. можно одновременно изменять и температуру, и давление, не вызывая изменения числа фаз в системе:
с = 1 – 1 + 2 = 2
На каждой из линий число фаз в системе равно двум и, согласно правилу фаз, система моновариантна, т.е. для каждого значения температуры имеется только одно значение давления, при котором система двухфазна:
с = 1 – 2 + 2 = 1
Влияние давления на температуру фазового перехода описывает уравнение Клаузиуса – Клапейрона:
 (17.1)
(17.1)
Здесь ΔVфп = V2 – V1 есть изменение молярного объема вещества при фазовом переходе (причем V2 относится к состоянию, переход в которое сопровождается поглощением теплоты). Уравнение Клаузиуса – Клапейрона позволяет объяснить наклон кривых равновесия на диаграмме состояния однокомпонентной системы. Для переходов "жидкость – пар" и "твердое вещество – пар" ΔV всегда больше нуля; поэтому кривые на диаграмме состояния, отвечающие этим равновесиям, всегда наклонены вправо (повышение температуры всегда увеличивает давление насыщенного пара). Поскольку молярный объем газа много больше молярного объема того же вещества в жидком или твердом агрегатном состояниях (Vг >> Vж, Vг >> Vт), уравнение (17.1) для частных случаев испарения и возгонки примет следующий вид:
 (17.2)
(17.2)
Для многих веществ скрытая теплота парообразования или возгонки постоянна в большом интервале температур; в этом случае уравнение (17.2) можно проинтегрировать:
 (17.3)
(17.3)
Кривая равновесия "твердое вещество – жидкость" на диаграммах состояния воды и висмута наклонена влево, а на диаграммах состояния остальных веществ – вправо. Это связано с тем, что плотность воды больше, чем плотность льда (и плотность жидкого висмута больше его плотности в твердом состоянии), т.е. плавление сопровождается уменьшением объема (ΔV < 0). Как следует из выражения (17.3), в этом случае увеличение давления будет понижать температуру фазового перехода "твердое тело – жидкость" (воду и висмут относят поэтому к т.н. аномальным веществам). Для всех остальных веществ (т.н. нормальные вещества) ΔVпл > 0 и, согласно уравнению Клаузиуса – Клапейрона, увеличение давления приводит к повышению температуры плавления.
Вещества, обладающие полиморфизмом в твердом состоянии
Некоторые вещества способны в твердом состоянии существовать в виде двух или нескольких полиморфных модификаций. К ним относится, в частности, сера, которая может существовать в виде ромбической (Sр) и моноклинной (Sм) серы (рис. 3.4).

Кристаллы различных модификаций одного и того же компонента отличаются физико–химическими свойствами и представляют собой различные твердые фазы. Взаимные превращения этих модификаций называются полиморфными переходами и относятся к фазовым переходам первого рода.
Если для каждой из двух модификаций имеется определенная область T давлений и температур, в которых она термодинамически устойчива, то взаимные превращения кристаллических модификаций могут осуществляться, в зависимости от условий, как в прямом, так и в обратном направлении (Sм ↔ Sр ). Такие превращения называются энантиотропными (в отличие от монотропных - односторонних – переходов от метастабильного к истинному равновесию).
Образование новых фаз в системе приводит к появлению на диаграмме состояния дополнительных кривых двухфазных равновесий. На ней имеются линии испарения AK, возгонки AO и плавления AD моноклинной серы, линии возгонки BO и плавления DE ромбической серы, а также линия сосуществования двух твердых модификаций: моноклинной и ромбической серы OD. На диаграмме имеются четыре области, отвечающие устойчивому существованию четырех фаз серы: парообразной (Sп), жидкой (Sж) и двухкристаллических (Sр и Sм). Для этой системы число тройных точек - три: точкаA (Sп ↔ Sж ↔ Sм ), точка O (Sп ↔ Sм ↔ Sр ) и точкаD (Sж ↔ Sм ↔ Sр ).
Таким образом, в однокомпонентных системах фазы – это одно и тоже вещество в различных агрегатных или аллотропных состояниях, а фазовые переходы – это агрегатные или полиморфные превращения этого вещества.