Основное уравнение МКТ
 , где k является постоянной Больцмана (отношение универсальной газовой постоянной R к числу Авогадро NA), i — число степеней свободы молекул (
, где k является постоянной Больцмана (отношение универсальной газовой постоянной R к числу Авогадро NA), i — число степеней свободы молекул ( в большинстве задач про идеальные газы, где молекулы предполагаются сферами малого радиуса, физическим аналогом которых могут служить инертные газы), а T - абсолютная температура.
в большинстве задач про идеальные газы, где молекулы предполагаются сферами малого радиуса, физическим аналогом которых могут служить инертные газы), а T - абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Средний квадрат скорости 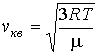
4. Одно атомные молекулы i=3
Двух i=5
Трех и более i= 6
Сте́пени свобо́ды — характеристики движения механической системы. Число степеней свободы определяет минимальное количество независимых переменных (обобщённых координат), необходимых для полного описания движения механической системы.
Теорема о равнораспределении кинетической энергии по степеням свободы, закон равнораспределения, теорема о равнораспределении — связывает температуру системы с её средней энергией в классической статистической механике. В первоначальном виде теорема утверждала, что при тепловом равновесии энергия разделена одинаково между её различными формами
5.
6.
7. Опыт Штерна — опыт, впервые проведённый немецким физиком Отто Штерном в 1920 году. Опыт явился одним из первых практических доказательств состоятельности молекулярно-кинетической теории строения вещества. В нём были непосредственно измерены скорости теплового движения молекул и подтверждено наличие распределения молекул газов по скоростям.
Для проведения опыта Штерном был подготовлен прибор, состоящий из двух цилиндров разного радиуса, ось которых совпадала и на ней располагалась платиновая проволока с нанесённым слоем серебра. В пространстве внутри цилиндров посредством непрерывной откачки воздуха поддерживалось достаточно низкое давление. При пропускании электрического тока через проволоку достигалась температура плавления серебра, из-за чего атомы начинали испаряться и летели к внутренней поверхности малого цилиндра равномерно и прямолинейно со скоростью v, соответствующей подаваемому на концы нити напряжению. Во внутреннем цилиндре была проделана узкая щель, через которую атомы могли беспрепятственно пролетать далее. Стенки цилиндров специально охлаждались, что способствовало оседанию попадающих на них атомов. В таком состоянии на внутренней поверхности большого цилиндра образовывалась достаточно чёткая узкая полоса серебряного налёта, расположенная прямо напротив щели малого цилиндра. Затем всю систему начинали вращать с некой достаточно большой угловой скоростью ω. При этом полоса налёта смещалась в сторону, противоположную направлению вращения, и теряла чёткость. Измерив смещение s наиболее тёмной части полосы от её положения, когда система покоилась, Штерн определил время полёта, через которое нашёл скорость движения молекул:
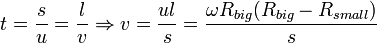 ,
,
где s — смещение полосы, l — расстояние между цилиндрами, а u — скорость движения точек внешнего цилиндра.
Найденная таким образом скорость движения атомов серебра совпала со скоростью, рассчитанной по законам молекулярно-кинетической теории, а тот факт, что получившаяся полоска была размытой, свидетельствовал в пользу того, что скорости атомов различны и распределены по некоторому закону — закону распределения Максвелла: атомы, двигавшиеся быстрее, смещались относительно полосы, полученной в состоянии покоя, на меньшие расстояния, чем те, которые двигались медленнее.
8. распределения Больцмана. Это распределение позволяет рассчитывать концентрацию газа, находящегося в равновесном состоянии во внешнем силовом поле. Причем это поле не должно быть обязательно гравитационным, а может иметь любое происхождение, в частности, быть электростатическим или полем сил инерции.
Барометрическая формула.
Если температура не зависит от высоты, то давление газа меняется с высотой по закону:
 , где
, где
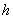 — высота,
— высота,
 — молярная газовая постоянная,
— молярная газовая постоянная,
 — постоянная Больцмана,
— постоянная Больцмана,
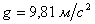 — ускорение свободного падения вблизи поверхности земли,
— ускорение свободного падения вблизи поверхности земли,
 — молярная масса газа,
— молярная масса газа,
 — масса одной молекулы,
— масса одной молекулы,
 — абсолютная температура.
— абсолютная температура.
Поделив барометрическую формулу на  , с учетом уравнения состояния идеального газа, получим распределение Больцмана — зависимость концентрации молекул от потенциальной энергии:
, с учетом уравнения состояния идеального газа, получим распределение Больцмана — зависимость концентрации молекул от потенциальной энергии:
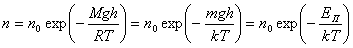 ,
,
где  — потенциальная энергия молекулы. В однородном поле силы тяжести
— потенциальная энергия молекулы. В однородном поле силы тяжести  .
.
9. Предметом термодинамики является изучение законов взаимных превращений различных видов энергии, связанных с переходами энергии между телами в форме теплоты и работы
Термодинамическая система — это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом.
10. Равновесным является такое состояние системы, при котором действие процессов внутри системы приводит к её выходу из равновесия, полностью компенсируется противодействием процессов, идущих во внешней среде.
Неравновесные это такие процессы, которые не сопровождаются состоянием равновесия. Для этих процессов характерно, что различные части системы имеют различные термодинамические параметры. Равновесное состояние является предельным случаем неравновесного состояния, если скорость стремится к нулю.
Если при равновесном процессе температура системы остается постоянной, то такой процесс называется изотермическим. Примером такого процесса является хранение сжиженных газов в подземных хранилищах.
Равновесный процесс, при котором постоянным является давление, называется изобарическим (изобарным). Примером изобарного процесса является подземная газификация подземного топлива, когда за счет горного давления и давление воздуха, нагнетаемого в пласт угля, общее давление в газовых продуктах сгорания остается постоянным.
Если при равновесном процессе остается постоянным объем, то такой процесс называется изохорным. Примером изохорного процесса служит термическое и электротермическое дробление крупных габаритов горных пород.
Если при равновесном процессе отсутствует теплообмен системы с окружающей средой, то такой процесс называется адиабатическим (адиабатным). В природе таких процессов не существует.
11. Работа, совершенная идеальным газом в изотермическом процессе, равна 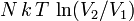 , где
, где  — число частиц газа,
— число частиц газа,  — температура,
— температура,  и
и  — объём газа в начале и конце процесса,
— объём газа в начале и конце процесса, 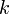 — постоянная Больцмана.
— постоянная Больцмана.
Работа, совершаемая газом при расширении или сжатии газа, равна 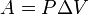 .
.
Адиабатический процесс – это процесс квазистатического расширения или сжатия газа в сосуде с теплонепроницаемыми стенками. Первый закон термодинамики для адиабатического процесса принимает вид
| A = –Δ U, |
где Δ U – изменение внутренней энергии. В адиабатическом процессе газ совершает работу за счет изменения внутренней энергии. Внутренняя энергия идеального газа изменяется пропорционально его температуре. Для 1 моля одноатомного газа
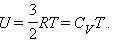
|
12. Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин.
Вну́тренняя эне́ргия тела (обозначается как E или U) — полная энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил...
13. Внутренняя энергия U одного моля идеального газа равна:
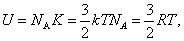 или или
|
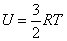
|
Количество теплоты, сообщаемой телу, идёт на увеличение внутренней энергии и на совершение телом работы:
 , ,
| (4.1.1) |
– это и есть первое начало термодинамики, или закон сохранения энергии в термодинамике.
Выражение (4.1.1) для малого изменения состояния системы будет иметь вид:

| (4.1.2) |
В этом выражении U – функция состояния системы; d U – её полный дифференциал, а δ Q и δ А таковыми не являются. В каждом состоянии система обладает определенным и только таким значением внутренней энергии, поэтому можно записать:
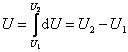 , ,
|
14. Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплотыδ Q, полученного телом, к соответствующему приращению его температуры δ T:
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества.

Молярная теплоемкость — теплоемкость 1 моля идеального газа.


Связь между молярной и удельной теплоемкостями
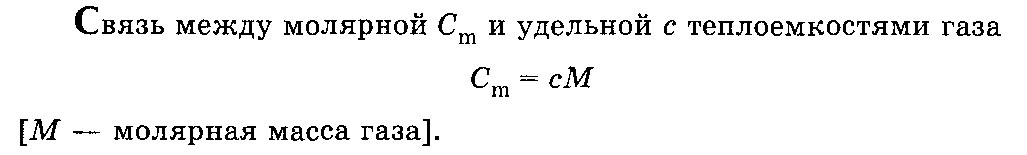
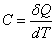
Далее под С подразумевается теплоемкость, отнесенная к одному молю газа, или молярная теплоемкость. Внутренняя энергия U также определена для одного моля газа. Если газ нагревается при постоянном объеме (изохорический процесс), т.е. совершаемая газом работа равна нулю, то
(14) 
Если состояние газа меняется при постоянном давлении (изобарический процесс), то в соответствии с (13)
(15) 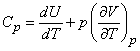
Использование уравнение состояния идеального газа (3) при v = 1 дает
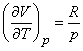
Следовательно, молярные теплоемкости идеального газа при постоянном давлении и при постоянном объеме связаны соотношением
(16) Cp = Cv + R уравнение майера
16.
17. Для идеальных газов, чью теплоёмкость можно считать постоянной, в случае квазистатического процесса адиабата имеет простейший вид и определяется уравнением[6][15][16]

где  — его объём,
— его объём,  — показатель адиабаты,
— показатель адиабаты, 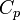 и
и  — теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.
— теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.


График адиабаты (жирная линия) на  диаграмме для газа.
диаграмме для газа.
 — давление газа;
— давление газа;
 — объём.
— объём.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду

где  — абсолютная температура газа. Или к виду
— абсолютная температура газа. Или к виду

18. Первое начало термодинамики:
Q = A + ΔU
В адиабатном процессе Q = 0, значит
A = - ΔU

где  — давление газа,
— давление газа, 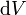 — малое приращение объёма.
— малое приращение объёма.
19.
Термодинами́ческие ци́клы — круговые процессы в термодинамике, то есть такие процессы, в которых начальные и конечные параметры, определяющие состояние рабочего тела (давление, объём, температура, энтропия), совпадают.
Его КПД равен, таким образом,

20. Обратимым называют цикл, который можно провести как в прямом, так и в обратном направлении в замкнутой системе. Суммарная энтропия системы при прохождении такого цикла не меняется. Единственным обратимым циклом для машины, в которой передача тепла осуществляется только между рабочим телом, нагревателем и холодильником, является Цикл Карно.
21. Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2 изотермических процессов
22. Неравенство Клаузиуса (1854): Количество теплоты, полученное системой при любом круговом процессе, делённое на абсолютную температуру, при которой оно было получено (приведённое количество теплоты), неположительно.
23. Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
24. 
среднее число столкнове-
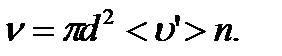 ний в одну секунду:
ний в одну секунду:
средняя длина свободного пробега

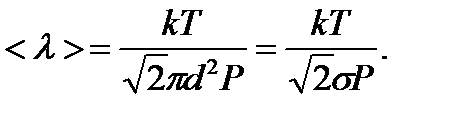
25. Диффузией Диффузией называется процесс переноса вещества
компоненты в смеси, приводящий к выравниванию
концентрации этой компоненты по всему объему системы
Теплопроводностью называется процесс переноса теплоты,
приводящий к выравниванию температуры по всему объему
системы
Вязкостью называется процесс
переноса импульса от слоя газа, движущегося с большей
скоростью, к слою, движущемуся медленнее, приводящий к
выравниванию скорости движения слоев газа по всему объему
системы
26. Тепловой поток, передаваемая теплопроводностью, пропорциональна градиенту температуры и площади сечения, перпендикулярного направлению теплового потока.
Q = -λ∙F∙ ∂t/∂n, (9.8)
или
q = -λ ∙ ∂t/∂n ∙no = -λ∙gradt, (9.9)
где: q – вектор плотности теплового потока;
λ – κоэффициент теплопроводности, [Вт/(м∙К)].
27. Газ называется разреженным, если его плотность столь мала, что средняя длина свободного пробега молекул < λ > может быть сравнима с линейными размерами l сосуда, в котором находится газ. Такое состояние газа называется вакуумом.
Различают следующие степени вакуума: сверхвысокий (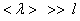 ), высокий (
), высокий ( ), средний (
), средний ( ) и низкий вакуум.
) и низкий вакуум.
Свойства разреженных газов отличаются от свойств неразреженных газов. Это видно из таблицы, где приведены некоторые характеристики различных степеней вакуума.
Таблица 3.1
| Характеристика | Вакуум | |||
| низкий | средний | высокий | сверхвысокий | |
| λ < l | λ ≈ l | λ > l | λ >> l | |
| Давление в мм рт.ст | 760 – 1 | 1 – 10–3 | 10–3 – 10–7 | 10–8 и менее |
| Число молекул в ед. объема (в м–3) | 1025 – 1022 | 1022 – 1019 | 1019 – 1013 | 1013 и менее |
| Зависимость от давления коэффициентов χ и η | Не зависят от давления | Определяется параметром

| Прямо пропорциональны давлению | Теплопроводность и вязкость практически отсутствуют |
Если из сосуда откачивать газ, то по мере понижения давления число столкновений молекул друг с другом уменьшается, что приводит к увеличению их длины свободного пробега. При достаточно большом разрежении столкновения между молекулами относительно редки, поэтому основную роль играют столкновения молекул со стенками сосуда.
В состоянии высокого вакуума уменьшение плотности разреженного газа приводит к соответствующей убыли частиц без изменения < λ >. Следовательно, уменьшается число носителей импульса или внутренней энергии в явлениях вязкости и теплопроводности. Коэффициенты переноса в этих явлениях прямо пропорциональны плотности газа. В сильно разреженных газах внутреннее трение, по существу, отсутствует.
28. Реальный газ - газ, свойства которого зависят от взаимодействия молекул.
Силы межмолекулярного взаимодействия - силы взаимодействия между
молекулами и атомами газа, не приводящие к образованию химических
соединений. Эти силы — короткодействующие (проявляются на расстояния ≤
10-9 м).
29.
Уравнение состояния
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:

где
§  — давление,
— давление,
§  — молярный объём,
— молярный объём,
§  — абсолютная температура,
— абсолютная температура,
§ 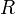 — универсальная газовая постоянная.
— универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка  учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка
учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка  — силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
— силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
Для 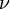 молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
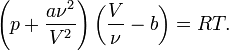
где
§  — объём,
— объём,
[править]Внутренняя энергия газа Ван-дер-Ваальса
Потенциальная энергия межмолекулярных сил взаимодействия вычисляется как работа, которую совершают эти силы, при разведении молекул на бесконечность:

Внутренняя энергия газа Ван-дер-Ваальса складывается из его кинетической энергии (энергии теплового движения молекул) и только что нами посчитанной потенциальной. Так, для одного моль газа:

где  — молярная теплоёмкость при постоянном объёме, которая предполагается не зависящей от температуры.
— молярная теплоёмкость при постоянном объёме, которая предполагается не зависящей от температуры.