Процесс, обратный образованию ковалентной связи по обменному механизму, в результате которого образуются два свободных радикала, называется гомолитическим разрывом связи.

При донорно-акцепторном механизме ковалентная связь между двумя атомами образуется также за счет двух электронов – неподеленной электронной пары атома-донора и пустой орбитали атома-акцептора. В органической химии частицу с неподеленной электронной парой называют нуклеофилом, а частицу с пустой орбиталью – электрофилом. Таким образом, нуклеофил может взаимодействовать с электрофилом с образованием связи по донорно‑акцепторному механизму. Две нуклеофильные частицы, равно как и две электрофильные частицы не взаимодействуют друг с другом.
ЗАПОМНИТЬ!!!
Процесс обратный образованию связи по донорно-акцепторному механизму называется гетеролитическим разрывом сввязи. При этом часто (но не всегда!!!) образуются заряженные частицы ‑ ионы.
ЗАПОМНИТЬ!!!!
Частица с неподеленной электронной парой называется нуклеофил, а частица с пустой орбиталью – электрофил.

4. Приведите все структурные формулы и названия изомерных соединений следующего состава:
-алканы C5H12;
-алкены C4H8;
-спирты C3H8O.
Ответ:
алканы состава С5Н12:
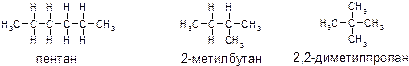
Алкены состава С4Н8:

Спирты состава С3Н8О:

5. Являются ли пары изображенных ниже веществ одним и тем же или разными веществами:

Ответ:
В случае (а) изображена одна и та же молекула – н-бутана. Дело в том, что относительно любой одинарной связи возможно относительно свободное вращение. Такое вращение может происходить и относительно центральной связи углерод‑углерод, как изображено ниже. Это приводит к тому, что молекулы бутана существуют в виде бесчисленного множества форм – так называемых конформаций, которые легко переходят друг в друга при комнатной (и пониженной) температуре.

В случае (б) речь идет о разных веществах – цис-бутене-2 и транс-бутене-2. Дело в том, что центральные атомы углерода связаны двойной связью, относительно которой уже невозможно свободное вращение. Поэтому цис-изомер не может свободно проходить в транс-изомер. Существуют два совершенно различных вещества – цис-бутен-2 и транс-бутен-2.

6. Какой тип реакций (замещения или присоединения) характерен для алканов, алкенов, алкинов, ароматических углеводородов? Напишите реакции, характерные для этих классов соединений, а также для спиртов, альдегидов, карбоновых кислот, аминов и аминокислот.
Ответ (знать все приведенные ниже реакции):
Алканы. Для алканов характерны реакции замещения (чаще всего при действии галогенов, хлора и брома), при этом могут замещаться один (уравнения 1, 3) или несколько (уравнение 2) атомов водорода.
Рассмотрим уравнение 1 более подробно. Строение продукта реакции – хлорметана – очень похоже на строение исходного соединения – метана. В процессе реакции один атом водорода в молекуле метана заменяется (замещается) на атом хлора, поэтому говорят, что происходит реакция замещения.
Сходным образом протекают также и реакции 2 и 3: чтобы правильно изобразить продукт необходимо перерисовать структурную формулу исходного соединения, заменив при этом атом водорода на соответствующий заместитель.

Алкены. Алкены вступают в реакции присоединения по двойной связи (реакции 4 - 9). Присоединение воды часто называют реакцией гидратации (8).
Суть этих реакций заключается в том, что в двойной связи С=С происходит разрыв более слабой π-связи, и к каждому из атомов углерода присоединяется одновалентный атом (типа H, Cl, Br) или одновалентный остаток (типа ОН). Все остальные связи, которые были в исходном алкене остаются незатронутыми и сохраняются в продукте реакции. Ниже изображена упрощенная схема, иллюстрирующая протекание реакций присоединения по двойной углерод-углеродной связи алкенов.


Для реакций алкенов (с несимметрично замещённойдвойной связью) с водой и галогеноводородами (реакции 10, 11) необходимо решить: к котрому из атомов C присоединится H, а к которому - OH или галоген? Чаще всего можно воспользоваться правилом Марковникова и присоединить атом H к тому атому углерода двойной связи, который связан с большим количеством атомов водорода (наиболее «гидрогенизированный»)

Алкины. Алкины вступают в реакции присоединения по тройной связи(13 - 17), при этом могут присоединять один (уравнения 13, 15) или два (14, 16) эквивалента реагентов. В отличие от алкенов, гидратация алкинов (т.н. реакция Кучерова) (17) приводит не к спиртам (8), а к карбонильным соединениям.
Более подробно поясним реакцию 13. В молекуле ацетилена содержится три связи углерод‑углерод, или как говорят одна тройная связь  . Из этих трех связей рвется только одна связь, а две остаются, поэтому продукт реакции содержит фрагмент
. Из этих трех связей рвется только одна связь, а две остаются, поэтому продукт реакции содержит фрагмент  . При этом, к каждому атому углерода присоединяется по одному атому водорода, что обеспечивает четырехвалентность углерода в продукте реакции.
. При этом, к каждому атому углерода присоединяется по одному атому водорода, что обеспечивает четырехвалентность углерода в продукте реакции.
Все остальные связи, которые содержались в исходной молекуле ацетилена не затрагиваются и остаются в продукте реакции.
Аналогично проекает реакция 15. В реакции 16 сначала происходит рзрыв двух связей углерод-углерод, а к каждому из атомов углерода присоединяется по два атома хлора.

Ароматические углеводороды (арены). Вступают в реакции замещения атомов водорода (бромирование 18, нитрование 19):

Кислород содержащие соединения. Спирты в реакции с активными металлами, подобно кислотам, выделяют водород (20). При нагревании с серной кислотой происходит реакция дегидратации (21). Реакция 21 по сути обратна реакции 8: от соседних атомов углерода отщепляются одновалентные атомы или группы, при этом между двумя соседними атомами углерода формируется еще одна связь углерод-углерод, так что в продукте реакции имеется двойная связь  .
.

Альдегиды вступают в реакции восстановления (22) и окисления (23). Рекция 23 носит название «реакция сребряного зеркала», так как выделяющееся в ходе нее серебро дает на стенке зеркальный налет.
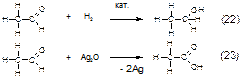
Карбоновые кислоты взаимодействуют с гидроксидами с образованием солей (24), а со спиртами (в присутствии сильных кислот в качестве катализатора) – с образованием сложных эфиров (25).

Азот содержащие соединения. Амины реагируют с сильными кислотами с образованием солей аммония (26). Для аминокислот, кроме этого, важна реакция образования пептидов при повышенной температуре (27):

7. Приведите механизм образования хлорэтана при взаимодействии этилена с хлороводородом.
Ответ: С точки зрения механизма реакции алкенам характерны реакции электрофильного присоединения. Механизм этого превращения изображен ниже. На первой стадии происходит диссоциация хлороводорода на протон и хлорид-анион (гетеролитический разрыв связи H-Cl, смотри вопрос 3). При этом образуется протон Н+, содержащий вакантную орбиталь, а также хлоид-анион Сl-, обладающий неподеленной электронной парой. Частицы с вакантной обиталью (типа протона Н+) называют электрофильными, а с неподеленной электронной парой – нуклеофилами.
Первым с молекулой этилена взаимодействует электрофильная частица – протон Н+ (поэтому и говорят, что алкенам характерны реакции электрофильного присоединения). На этой стадии происходит присоединение протона с одновременным гетеролитическим разрывом π-связи в молекуле этилена (если гетеролитический разрыв π‑связи происходил бы сам по себе, то образовывалась бы частица  ). Присоединение протона происходит за счет образования новой связи С-Н по донорно-акцепторному механизму (т.е. Н+ присоединяется к тому атому углерода
). Присоединение протона происходит за счет образования новой связи С-Н по донорно-акцепторному механизму (т.е. Н+ присоединяется к тому атому углерода  , на котором находится отрицательный заряд, т.е. неподеленная электронная пара). Присоединение протона ведет к образованию этильного катиона – выполняется закон сохранения заряда, который в данном случае заключается в следующем: взаимодействует электронейтральная молекула этилена и положительно-заряженный ион Н+, суммарный заряд реагентов равен +1, поэтому и суммарный заряд продуктов должен быть равен +1, что и выполняется: образуется этильный катион С2Н5+.
, на котором находится отрицательный заряд, т.е. неподеленная электронная пара). Присоединение протона ведет к образованию этильного катиона – выполняется закон сохранения заряда, который в данном случае заключается в следующем: взаимодействует электронейтральная молекула этилена и положительно-заряженный ион Н+, суммарный заряд реагентов равен +1, поэтому и суммарный заряд продуктов должен быть равен +1, что и выполняется: образуется этильный катион С2Н5+.
На последней стадии электрофильная частица – этильный катон взаимодействует с нуклеофильной – хлорид-анионом с образованием новой связи C—Cl по донорно-акцепторному механизму.
