ПЛАН ЗАНЯТИЯ № 1
Дисциплина: Химия.
Тема: Общие способы получения металлов. Сплавы. Распознавание руд железа.
Цель занятия: изучить новые понятия: металлотермия, пирометаллургия, гидрометаллургия и электрометаллургия, способы получения металлов, расширить знания обучающихся за счет рассмотрения таких понятий как сплавы и коррозия металлов.
Планируемые результаты
Предметные: знать основные способы получения металлов и сплавов в промышленности, способы защиты от коррозии металлических конструкций, основные отличия состава и свойств черных и цветных сплавов.
Метапредметные: связывать изученный материал со своей профессиональной деятельностью, использовать приобретенные знания и умения в практической деятельности и повседневной жизни для объяснения химических явлений, происходящих в природе, быту и на производстве.
Личностные: иметь правильное представление о месте химии в современной научной картине мира; понимать роль химии для человека при решении практических задач.
Норма времени: 2 часа
Вид занятия: Лекция.
План занятия:
1) Общие способы получения металлов.
2) Понятие о металлургии.
3) Металлотермия.
4) Пирометаллургия, гидрометаллургия и электрометаллургия.
5) Коррозия.
6) Сплавычерные и цветные.
7) Распознавание руд железа.
Оснащение: Учебник, плакат «коррозия металлов».
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций с прил. на электрон. Носителе (DVD) / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
Тема 1. ОБЩИЕ СПОСОБЫПОЛУЧЕНИЯ МЕТАЛЛОВ. СПЛАВЫ.
План:
1. Общие способы получения металлов.
2. Понятие о металлургии.
3. Металлотермия.
4. Пирометаллургия, гидрометаллургия и электрометаллургия.
5. Коррозия.
6. Сплавычерные и цветные.
Общие способы получения металлов.
1. Восстановление металлов из оксидов углем или угарным газом
MеxOy+ C = CO2 + Me,
MеxOy+ C = CO + Me,
MеxOy+ CO = CO2+ Me
Например,
ZnOy+ C= CO+ Zn
Fe3O4+ 4COt= 4CO2+ 3Fe
MgO+Ct=Mg+CO
2. Обжиг сульфидов с последующим восстановлением (если металл находится в руде в виде соли или основания, то последние предварительно переводят в оксид)
1 стадия – MеxSy+O2=MеxOy+SO2
2 стадия - MеxOy+ C = CO2 + Me или MеxOy+ CO = CO2+ Me
Например,
2ZnS+ 3O2t= 2ZnO+ 2SO2↑
MgCO3t= MgO + CO2↑
3 Алюмотермия (в тех случаях, когда нельзя восстановить углём или угарным газом из-за образования карбида или гидрида)
MеxOy+ Al = Al2O3+ Me
Например,
4SrO + 2Alt= Sr(AlO2)2+ 3Sr
3MnO2+ 4Alt= 3Mn + 2Al2O3
2Al+ 3BaOt= 3Ba+Al2O3 (получают барий высокой чистоты)
4. Водородотермия - для получения металлов особой чистоты
MеxOy+ H2= H2O + Me
Например,
WO3+ 3H2t= W + 3H2O↑
MoO3+ 3H2t= Mo + 3H2O↑
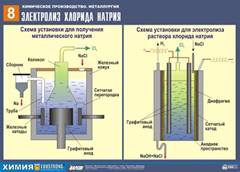
Восстановление металлов электрическим током (электролиз)
А) Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов солей (хлоридов):
2NaCl –расплав, электр. ток.→2Na+Cl2↑
CaCl2 –расплав, электр. ток.→Ca+Cl2↑
расплавов гидроксидов:
4NaOH –расплав, электр. ток.→ 4Na+O2↑ + 2H2O (!!! используют изредка для Na)
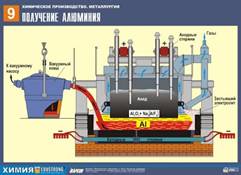
Б) Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na3AlF6 (из бокситов):
2Al2O3 –расплав в криолите, электр. ток.→ 4Al + 3O2↑
В) Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:
2CuSO4+2H2O –раствор, электр. ток. →2Cu+O2+ 2H2SO4
Понятие о металлургии
Как вы знаете металлы в природе встречаются как в чистом виде так и в виде сложных соединений. Только в свободном виде встречаются золото и платина. И в самородном виде, и в форме соединений могут находиться в природе серебро, медь, ртуть и олово. Все остальные металлы, которые находятся в ряду напряжения до Sn, встречаются в природе только в виде соединений.
Среди таких соединений:
· хлориды (сильвин, галит, или каменная соль, сильвинит);
· нитраты (чилийская селитра);
· сульфаты (глауберова соль, гипс);
· карбонаты (мел, мрамор, известняк; магнезит, доломит);
· силикаты, в том числе содержащие алюминий – алюмосиликаты (белая глина, или каолин, полевые шпаты, слюда);
· сульфиды (серный колчедан, киноварь, цинковая обманка);
· фосфаты.
Минералы и горные породы, содержащие металлы или их соединения и пригодные для промышленного получения металлов, называются рудами.
Если руды содержат соединения двух или нескольких металлов, то они называются полиметаллическими. Например, медно-молибденовые, свинцово-серебрянные и т. д.
Металлургия – это отрасль промышленности, которая занимается получением металлов из руд. Так же называется и наука о промышленных способах получения металлов из руд.
Металлотермия.
Металлотермия - процессы получения металлов, основанные на восстановлении их оксидов и галогенидов другими, более активными металлами; протекают с выделением тепла. С помощью металлотермии получают такие металлы, как, например, Ti, U, РЗЭ, Nb, Та, безуглеродистые сплавы, отличающиеся высокой чистотой (главным образом по углероду). Высокая чистота конечных продуктов металлотермического восстановления обусловливает, например, высокую пластичность полученных металлов, т. к. содержание мн. примесей в них, в первую очередь примесей внедрения, на очень низком уровне.
Металлотермические процессы инициируются теплом. Исходным соединениями для металлотермии в основном служат оксиды, хлориды и фториды.
Пирометаллургия, гидрометаллургия и электрометаллургия.
 Способы получения металлов обычно разделяют на три типа:
Способы получения металлов обычно разделяют на три типа:
· пирометаллургические (восстановление при высоких температурах);
· гидрометаллургические (восстановление из солей в растворах);
· электрометаллургические (электролиз раствора или расплава).
Пирометаллургически получают (методы извлечения металлов из руд под действием высоких температур. Оксидные руды и оксиды восстанавливают углем, оксидом углерода (II), более активным металлами (алюминий, магний)): чугун, сталь, медь, свинец, никель, хром и другие металлы.
FeO + C –> Fe + CO
Fe2O3 + 2Al –> 2Fe + Al2O3
Гидрометаллургически получают (методы получения металлов, основанные на химических реакциях, протекающих в растворах): золото, цинк, никель и некоторые другие металлы.
CuSO4 + Fe –> FeSO4 + Cu
Электрометаллургически получают (выделение металлов из их солей и оксидов под действием электрического тока): щелочные и щёлочноземельные металлы, алюминий, магний и другие металлы.
При разработке технологии получения химических веществ используются законы термодинамики, кинетики, теплотехники, физико-химического анализа и др. Учитываются, естественно, и экономические условия. В случае, если реакция обратима, применяется принцип Ле Шателье:
Если на систему, находящуюся в равновесии, воздействовать извне, то равновесие в системе сместится в сторону той реакции (прямой или обратной), которая приводит к частичной компенсации этого воздействия.
Химические методы применяются и при очистке выбросов, а также сточных вод химических производств.
Коррозия.
Коррозия наносит прямой ущерб, ежегодно от неё теряется около 1/3 произведённого за год во всём мире металла, но и косвенно разрушает конструкции, на которые был затрачен труд (машины, крыши, памятники архитектуры, мосты…) Тратятся ежегодно огромные средства на борьбу с этим явлением. Коррозия не щадит памятники архитектуры: Царь-пушку (1586 г.), Царь-колокол (1735 г.), медный всадник в Санкт-Петербурге, Памятник Минину и Пожарскому в Москве, только в этом случае налёт тёмно-зелёный, его называют патиной. Неизлечимо больна Эйфелева башня – символ Парижа, она изготовлена из обычной стали и необратимо ржавеет и разрушается. Башню красили 18 раз, отчего её масса (9.00 тонн) каждый раз увеличивается на 70 тонн.
В результате коррозии уменьшается прочность, блеск, снижается электропроводность, возрастает трение между деталями.
Учебник Г.Е.Рудзитис, Ф.Г.Фельдман, Химия 11 класс, страница 1108 - 111.
1. Что такое коррозия?
2. Виды коррозии – химическая и электрохимическая.
3. Методы защиты от коррозии.