| Органические вещества | Неорганические вещества (сложные) | |
| Тип химической связи между атомами. | Ковалентные слабополярные или неполярные | Ионные или ковалентные полярные |
| Наличие связи между одинаковыми атомами. | Углерод-углеродные связи — основа существования всех органических веществ | Связи между одинаковыми атомами, как правило, не образуются |
| Тип кристаллической решетки. | Молекулярная кристаллическая решетка | Ионная, атомная, реже молекулярная кристаллическая решетка |
| Относительная молекулярная масса Мг | Значения относительных молекулярных масс варьируются в большом диапазоне, вплоть до очень высоких значений | Значения относительных молекулярных масс невелики |
| Явления гомологии и изомерии | Эти явления широко распространены — это важнейшая причина многообразия органических веществ | Единичные случаи |
| . Взаимодействие с другими веществами | Скорости реакций невелики; выход продуктов, как правило, небольшой, так как образуются побочные продукты; реакции обратимы | Взаимодействие протекает быстро, во многих случаях мгновенно и с количественным выходом продукта реакции |
| Образование полимерных соединений | Многие вещества способны к реакциям полимеризации и поликонденсации, в результате которых образуются полимерные соединения | Нехарактерно |
| Распространение на планете Земля | Составляют основную массу биосферы | Составляют основную массу неживой природы: атмосферы, гидросферы, литосферы |
Валентность.
Атомы углерода, входящие в состав органических соединений, всегда будут четырёхвалентны, имеют электронную конфигурацию 1s2s22p2 и могут находиться в трех валентных состояниях

Первое валентное состояние (на примере метана СН4). При образовании молекулы метана атом углерода переходит в возбужденное состояние:

Четыре неспаренных электрона (2s и 2р) участвуют в образовании четырех б - связей. При этом возникают гибридные орбитали. Гибридизация орбиталей - процесс выравнивания их по форме и энергии. Число гибридных орбиталей равно числу исходных орбиталей. В молекуле метана и во всех молекулах органических веществ по месту одинарной связи атомы углерода будут находиться в состоянии бр3 - гибридизации, т.е. у атома углерода гибридизации подверглись орбитали одного s - и трех р - электронов и образовались 4 одинаковые гибридные орбитали.
 sp3 – гибридные облака располагаются под углом 109°28`.
sp3 – гибридные облака располагаются под углом 109°28`.
Второе валентное состояние атома углерода на примере этилена (C2H4)
В молекуле этилена каждый атом углерода соеденён с тремя другими атомами, поэтому в гибридизацию вступают З орбитали: одна s и две р, т.е. происходит sр2 - гибридизация.
Эти орбитали располагаются под углом 120° по отношению друг к другу.

Две негибридные орбитали перекрываются перпендикулярно плоскости и образуют – связь.
Третье валентное состояние атома углерода (на примере ацетилена С2Н2). В молекуле ацетилена атом углерода соединен с двумя другими атомами, поэтому в гибридизацию вступают две орбитали: одна s и одна p, т.е. происходит sp-гибридизация.
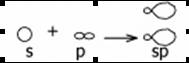
Эти орбитали располагаются под углом 180є по отношению друг к другу.


Не вступившие в гибридизацию две p-отбитали при боковом перекрывании образуют две π-связи, расположенные во взаимно перпендикулярных плоскостях.