Тема: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР)
После изучения темы студент должен знать:
1) Определение понятия «степень окисления», в чем отличие его от понятий «валентность», «заряд иона», «эффективный заряд»?
2) Какие процессы называются окислением и восстановлением?
3) Какие вещества и частицы проявляют свойства окислителей и восстановителей?
4) Что называется эквивалентом окислителя или восстановителя.
5) Что называется электродным потенциалом? Какова связь энергии Гиббса и электродного потенциала.
6) Как электродный потенциал зависит от концентрации, рН, комплексообразования, произведения растворимости? Уравнение Нернста.
7) В чем сущность электролиза растворов и расплавов солей и щелочей?
8) Принцип работы гальванических элементов.
Уметь:
1) прогнозировать на качественном уровне продукты ОВ реакции (выносится на экзамен);
2) подбирать коэффициенты ОВР методом электронного баланса и ионно-электронным методом;
3) вычислять реальные потенциалы, используя таблицу стандартных потенциалов и уравнение Нернста;
4) определять направление окислительно-восстановительных реакций по электродвижущей силе реакции, пользуясь таблицами электродных потенциалов
5) Составлять схемы электролиза растворов и расплавов веществ
6) Составлять схемы работы гальванических элементов.
Интегрированные ключевые умения (выносятся на экзамен)
1. Прогнозирование на качественном уровне продукты ОВ реакции;
2. Определение направления окислительно-восстановительных реакций по изменению ЭДС.
3. Составление уравнений ОВР с подбором коэффициентов ионно-электронным методом
4. Составление схем электролиза и расчет по ним.
Задания для подготовки к занятиям
1. Выучить наизусть определение понятий (знания 1-6).
2. Разобраться и потренироваться в умениях (умения 1-6). Использовать для этого домашнее задание.
3. Подготовиться к выполнению лабораторного эксперимента, оформить опыты по примеру. Таблица.
Таблица. Пример оформления опытов по изучению химических свойств веществ
| № п/п | Название. Ход работы. | Т.Б | Результат | Объяснение. Уравнения реакции. Выводы. |
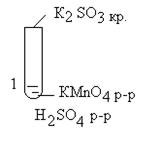
| КМnO4 окислитнль-ожоговое действие | Обес цве чива ние | 2КМnO4+5К2SO3+3H2SO4=6K2SO4+2МnSO4+ 3H2O | |
| Вывод: Продукты в ОВР зависят от реакции среды |
Обучающие задачи
1 Определить степень окисления в молекулах и частицах MnO2; K2MnO4; MnO4–; Mn2O3.
Решение
MnO2: В молекулах суммарный заряд степеней окисления д.б. равен нулю, суммарная степень окисления двух атомов кислорода равна 2•(-2) = -4; поэтому марганец должен иметь степень окисления +4.
K2MnO4: Суммарная степень окисления четырех атомов кислорода 4•(-2) = -8, поэтому вся остаточная часть должна иметь суммарную степень окисления +8, т.к. два атома калия имеют суммарную степень окисления +2, то на марганец остается +8 – 2 = +6, т.е. Mn+6, или алгебраически:
+2 + х + (-8) = 0; х = +6, или:
(-2) • 4 = (8); – 8 => +8; 8 – 2 = 6; 6: 1 = (+6)
MnO4–: Суммарная степень окисления иона равна его заряду, поэтому, обозначив степень окисления марганца за «Х», имеем:
–1 = х + (4•(-2); -1 = х – 8; х = +7
Формальная степень окисления марганца здесь +3; однако, такая степень окисления не характерна для него, поэтому следует подумать о том, что это сложный оксид
MnO × MnO2 где степень окисления соответственно +2 и +4.
Составить окислительно-восстановительный ряд хлора, определить роль хлора с различной степенью окисления в ОВР.
Решение
Электронная конфигурация валентного слоя хлора 3s23p53d0;
т.к. атом может принять один электрон, то минимальная степень окисления Cl–1, при возбуждении получается 1, 3, 5, 7 неспаренных электронов, которые атом может отдать, поэтому степень окисления может быть Cl+1, Cl+3, Cl+5, Cl+7. Окислительно-восстановительный ряд хлора:
Cl-1, Cl20, Cl+1, Cl+3, Cl+5, Cl+7,
т.к. Cl-1 может только по в ышать степень окисления, то Cl- является только в осстановителем (подчеркнутая буква «в»- мнемоническое правило для запоминания). Cl+7 может только уменьшать степень окисления, поэтому он проявляет только окислительные свойства. Остальные атомы хлора проявляют и окислительные и восстановительные свойства.
2. Определить роли в окислительно-восстановительных реакциях веществ: PbO2, H2O2, HNO3, H2SO3, H2Se.
Решение
Степень окисления свинца +4. Это максимальная степень окисления, поэтому PbO2 проявляет только окислительные свойства.
Кислород пероксида водорода может уменьшать степень окисления с О-1 до О-2 (Н2О), а может увеличивать до нуля (О2).
Н2О2 + 2Н+ + 2ē = 2Н2О
О2 + 2Н+ + 2ē = Н2О2
Поэтому пероксид водорода проявляет окислительные и восстановительные свойства в зависимости от реагента.
Степень окисления азота N+5 в азотной кислоте максимальная. Азотная кислота проявляет только окислительные свойства.
Сера в H2SO3 находится в степени окисления +4, это промежуточная степень окисления, сернистая кислота проявляет и окислительные и восстановительные свойства.
Селен в H2Se находится в степени окисления (–2), поэтому H2Se обладает только восстановительными свойствами.
3. Определить эквиваленты веществ в следующих процессах:
а) MnО4– + 2H2O + 3ē = MnO2 + 4OH–
б) превращение KI ® I2
Решение
Эквивалентом окислителя (или восстановителя) называется такое его количество, которое присоединяет (или освобождает) 1 моль электронов.
а) Составим пропорцию:
1 моль MnO4– присоединяет 3ē
х моль MnO4– присоединяет 1ē;
отсюда: 1/х = 3/1; х = 1/3, эквивалент MnO4– в данном процессе равен 1/3.
б) 2I- - 2ē = I20;
2моль I- освобождает 2 моль ē
х моль I- освобождает 1 моль ē,
отсюда 2/х = 2/1; х = (2 × 1)/2 = 1, эквивалент KI в данном процессе равен 1.
4. Закончить уравнение реакций
а) HBr + KMnO4 ® MnBr2 +
б) KI + KNO2 + CH3COOH ® NO +
в) P2O3 + H2O ® PH3 +
г) As3O33- + I2 + H2O ® AsO43- +
Решение
а) т. к. бром находится в минимальной степени окисления -1, то он может повысить степень окисления до 0 (Br2), марганец находится в максимальной степени окисления, может понизить свою степень окисления, т.к. среда кислая, то до Mn2+, который связывает ионы Br –, образуется также вода
HBr + KMnO4 ® MnBr2 + Br2 + H2O + KBr
б) азот был в степени окисления +3, понизил степень окисления до +2(NO), поэтому I- должен только повысить степень окисления, обычно до I2
KI + KNO2 + CH3COOH ® I2 + NO + CH3COOH + H2O
в) фосфор изменяет степень окисления с +3 до –3. Другие элементы в данной реакции не измменяют степень окисления. Поэтому фосфор должен повысить степень окисления до +5, продукты:
P2O3 + H2O ® PH3 + H3PO4
г) мышьяк меняет степень окисления с +3(AsO33-) до +5(AsO43-). Иод тогда должен понизить степень окисления до –1(I-). Продукты:
As3- + I2 + H2O ® AsO43- + 2I–,
или в молекулярном виде:
K3AsO4 + I2 + H2O ® K3AsO4 + HI.
Умение 6. Подобрать коэффициенты в уравнениях (умения 5).
а) HBr + KMnO4 ® MnBr2 + Br2 + H2O + KBr
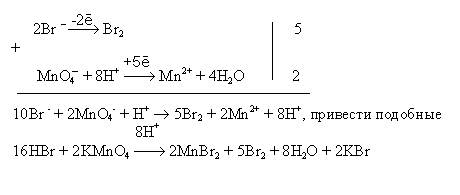
Умения 6 – см. обучающие задачи в [5].