ЛАБОРАТОРНАЯ РАБОТА №1
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫГАЗООБРАЗНОГО ВЕЩЕСТВА
Теоретическая часть: Атомно-молекулярное учение. Понятия: атом, молекула, химический элемент, относительная молекулярная масса, количество вещества, молярная масса, молярный объем газообразных веществ при н.у. Законы стехиометрии (формулировка, математическое выражение): закон сохранения массы веществ, закон кратных отношений, закон постоянства состава, закон объемных отношений, закон Авогадро и следствия из него, объединенный закон газового состояния, уравнение Менделеева – Клапейрона. Вывод формул для расчета М(СО2) с использованием уравнения Менделеева - Клапейрона и следствий из закона Авогадро. Решение задач. №№ 36, 43, 44, 48, 53, 54, 57, 69, 75,86,87,99,101,106,124,128,129,162
Практическая часть: оборудование - установка для получения и очистки СО2, технохимические весы (0,01 г), барометр (2 гПа), термометр (1 °С), мерный цилиндр (1 мл), колба плоскодонная с резиновой пробкой. Реактивы: мрамор (СаСО3), 10 % раствор соляной кислоты (HCl), бикарбонат натрия (NaHCO3), серная кислота концентрированная (H2SO4, 98 %).
Вывод формулы для расчета М (СО2)
Используем для вывода формулы для расчета М(СО 2) уравнение Менделеева - Клапейрона:
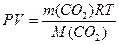 ,
, 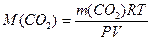 (1.1)
(1.1)
где m(CO2) - масса CO2, г; P - давление газа, Па; V - объем газа, м3; R - универсальная газовая постоянная, Дж / моль • К; T - температура, К; M(CO2) - молярная масса CO2, г/моль.
Закон Авогадро:
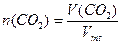 ,
, 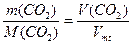
где V(CO2) - объем газа, мл; Vmt - молярный объем в условиях опыта, мл.
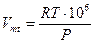 (1.2)
(1.2)
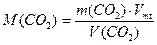 (1.3)
(1.3)
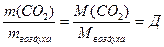
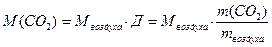
 29 г/моль.
29 г/моль. 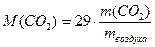 (1.4)
(1.4)
Описание установки для получения оксида углерода представлено на рисунке 1.

Рис. 1. Установка для получения оксида углерода
1- аппарат Киппа; 2, 3 - промывные склянки; 4 - газовая трубка; 5 - плоскодонная колба; 6 - кран.
Получение углекислого газа производится в аппарате Киппа (1) при действии на мрамор 10% соляной кислоты. После выхода из аппарата Киппа газ нужно очистить от примесей путем пропускания через склянки: (2) - наполнена бикарбонатом натрия, для очистки от примесей хлористого водорода, (3) - наполнена концентрированной серной кислотой для удаления паров воды.
План эксперимента
1. Чистую сухую колбу (5) плотно закрыть резиновой пробкой и отметить резиновым кольцом (или специальным карандашом по стеклу) уровень, до которого вошла пробка в горло колбы.
2. Взвесить колбу на весах. Записать массу колбы с воздухом в таблицу
3. Наполнить колбу углекислым газом. Для чего опустить в колбу до дна газовую трубку (4) от склянки (3), открыть кран (6) аппарата Киппа и 2 - 3 минуты пропускать углекислый газ (полноту заполнения колбы проверить зажженной спичкой). Затем, не закрывая крана, вынуть газоотводную трубку, закрыть колбу пробкой до отметки. Закрыть кран (6) аппарата Киппа.
4. Взвесить на тех же весах колбу с углекислым газом.
5. Заполнение колбы повторить, взвесив еще раз колбу с СО2. Результаты взвешиваний не должны расходиться более чем на 0,01 г. Записать массу колбы с углекислым газом (m2).
6. Записать в таблицу 1 показания термометра и барометра, имеющихся в лаборатории.
7. Измерить объем колбы. Для этого наполнить колбу водопроводной водой до отметки, вылить воду в мерный цилиндр и записать результат измерения (Vt) в таблицу.
Таблица 1.
Результаты измерений и вычислений
| Измеренная или рассчитанная величина | Обозначение | Единица Измерения | Числовое значение | Точность измерения величины |
| Масса колбы с воздухом | m1 | г | 0,01 | |
| Масса колбы с углекислым газом | m2 | г | 0,01 | |
| Давление | Р | Па | ||
| Температура | Т | К | ||
| Молярный объем в условиях опыта | V mt | мл | ||
| Объем колбы | Vt | мл | ||
| Масса воздуха в объеме колбы | m3 | г | 0,01 | |
| Масса пустой колбы | m4 | г | 0,01 | |
| Масса углекислого газа в объеме колбы | m5 | г | 0,01 | |
| Молярная масса углекислого газа а) опытная, б) теоретическая | M(CO2) | г/моль г/моль | 0,1 0,1 | |
| Относительная погрешность определения | e | % | 0,1 |
Расчеты и выводы
1. Дополнительные сведения, необходимые для обработки результатов и оформления отчета:
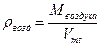
где рвозд - плотность воздуха, г/см3; М(воздуха) - молярная масса воздуха, г/моль;
Vmt - молярный объем в условиях опыта (1.2), мл.
Вычислите массу воздуха в колбе (m3): m3 = р·Vt
Вычислите массу пустой колбы (m4): m4 = m1 - m3
Вычислите массу углекислого газа в колбе (m5): m5 = m2 - m4
Результаты запишите в таблицу 1.
2. Используя результаты опыта, вычислите M(CO2) опытное тремя способами с использованием уравнения Менделеева - Клапейрона (1.1), закона Авогадро (1.3, 1.4)
Рассчитайте теоретическое значение M(CO2), используя величины М(С), М(О).
Внесите в таблицу Mтеор и Mопытн - наиболее близкое по значению к Mтеор.
Используя табличные значения Mтеор и Mопытн, рассчитайте относительную погрешность определения М (СО2). Сдайте отчет на проверку.