Опыт 1: Влияние концентрации реагирующих веществ на скорость гомогенной химической реакции.
В четыре стакана емкостью 100 мл налить по 20 мл раствора сульфита натрия, подкисленного серной кислотой и содержащего небольшое количество крахмала (1 г соли, 0,95 мл концентрированной серной кислоты, 0,1 г крахмала в 1 л раствора). В четыре других стаканчика налить 20, 10, 5 и 2,5 мл раствора иодата калия KJO3 (3,9 г соли в 1 л раствора). В последние три из четырех стаканчиков добавить соответственно 10, 15 и 17,5 мл дистиллированной воды. Сливая попарно растворы сульфита натрия и иодата калия, отмечать по секундомеру время появления окраски. Результаты записать в таблицу:
Построить график зависимости относительной скорости реакции  от относительной концентрации иодата калия С(KJO3)отн.. Написать уравнение реакции в молекулярной и сокращенно-ионной формах. Отвечает ли это уравнение механизму протекания реакции? Ответ обосновать.
от относительной концентрации иодата калия С(KJO3)отн.. Написать уравнение реакции в молекулярной и сокращенно-ионной формах. Отвечает ли это уравнение механизму протекания реакции? Ответ обосновать.
| Номер опыта | V(KJO3), мл | V(Na2SO3), мл | С(KJO3)отн. | Время t, с. | uр-цииотн., 1/c |
| 2.5 | |||||
Опыт 2: Влияние величины поверхности на скорость гетерогенной химической реакции.
В две пробирки поместить равные по массе (не более 0,3 г) образцы мела: в одну пробирку порошок, в другую - кусочек. В обе пробирки одновременно влить по 1-2 мл 2н. НСl. Сравнить скорость растворения мела в обеих пробирках. Написать уравнение реакции.
Опыт 3: Автокатализ.
Автокаталитическими называют реакции, катализатором в которых служит один из продуктов реакции. Примером является окисление щавелевой кислоты перманганатом в кислой среде:
2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2 +8H2O
Катализатором этой реакции служат ионы Мn2+. В две пробирки налить по 1-2 мл разбавленного раствора перманганата калия, подкислить раствором серной кислоты и прилить равные объемы 1М раствора щавелевой кислоты. В одну из пробирок бросить кристаллик соли марганца (II). Сравнить скорость окисления щавелевой кислоты в обеих пробирках.
Опыт 4: Смещение химического равновесия при изменении концентрации реагирующих веществ.
К 20 мл дистиллированной воды в химическом стаканчике добавить по 1-2 капли растворов хлорида железа (III) и роданида аммония. Что происходит? Написать уравнение реакции. Полученный раствор разлить в 4 пробирки (по 1-2 мл). В первую добавить несколько капель концентрированного раствора хлорида железа (III), во вторую - концентрированного раствора роданида аммония, в третью - концентрированного раствора хлорида аммония, четвертую оставить для сравнения. Как изменяется интенсивность окраски раствора в первых трех пробирках? Дать объяснение, пользуясь выражением константы равновесия и принципом Ле-Шателье.
Опыт 5: Влияние температуры на химическое равновесие.
При взаимодействии иода с крахмалом образуется вещество сложного состава - иодокрахмал. Реакция экзотермическая и равновесие ее условно представить схемой:
иод + крахмал Û иодокрахмал + Q; DНор-ции < 0
В две пробирки налить по 5 мл свежеприготовленного раствора крахмала и добавить 1-4 капли раствора иода, содержащего небольшое количество иодида калия. Что наблюдаете? Одну из пробирок нагреть и сравнить с контрольной пробиркой. Охладить нагретую пробирку водой из под крана. Сравнить с контрольной пробиркой. Результаты опыта записать в таблицу:
| Номер опыта | Изменение температуры | Изменение интенсивности окраски | Скорость какой реакции увеличилась | Направление смещения равновесия |
Опыт 6: Ингибирование коррозии.
В два стаканчика поместить стальную проволоку (скрепка, гвоздь) и прилить по несколько мл соляной кислоты. В один из стаканов добавить 1-2 мл 40%-ного раствора формалина. Сравнить скорость коррозии стали в обоих стаканчиках.
ВОПРОСЫСАМОКОНТРОЛЯ ПО ТЕМЕ
"ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ"
1. Какая реакция называется самопроизвольной? Должна ли самопроизвольная реакция обязательно быть быстропротекающей?
2. Какие реакции называются практически необратимыми (односторонними)? Приведите примеры обратимых реакций.
3. Дать определение и математическое выражение скорости химической реакции.
4. Что называется константой скорости химической реакции и от каких факторов она зависит?
5. Сформулировать закон действующих масс и привести примеры.
6. Каков физический смысл константы химического равновесия и от каких факторов она зависит?
7. Написать уравнение закона действующих масс для следующих обратимых процессов:
а) Cl2 + H2O Û Cl- + H+ + HClO;
б) mA + nB Û pC
8. Каким образом константа равновесия связана с константами скорости прямой и обратной реакции?
9. Вычислить константу химического равновесия реакции NaCl + H2SO4 Û NaHSO4 + HCl, если равновесные концентрации [NaCl] и [H2SO4] составляют по 1 моль/л, а [NaHSO4] и [HCl] - по 0,4 моль/л.
10. Сформулировать принцип Ле-Шателье.
11. Как сместить равновесие вправо:
а) 3H2 + N2 Û 2NH3; DHo < 0
б) H2 + I2 Û 2HI; DHo < 0
в) 3O2 Û 2O3; DHo > 0
г) CN- + H2O Û HCN + OH-
д) Zn2+ + H2S Û ZnS + 2H+
ЛАБОРАТОРНАЯ РАБОТА № 3
ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ.
Водородный показатель рН. Вода, являясь слабым электролитом, в очень малой степени диссоциирует на ионы:
H2O Û H+ + OH-

Применив к данному обратимому процессу закон действующих масс:
Приняв концентрацию воды [H2O] величиной постоянной, равной 1000/18=55,56 моль/л, уравнение можно записать так:

Kw - постоянная величина - называется ионным произведением воды и при 22oС равна 10-14. Для чистой воды концентрация ионов водорода равна концентрации гидроксид-ионов. Следовательно, при 22oС

Десятичный логарифм концентрации водородных ионов, взятый с обратным знаком, называется водородным показателем и обозначается рН, т.е. рН = -lg[H+]. Понятие рН удобно применять для характеристики реакции растворов: нейтральная - рН = 7; кислая - рН < 7, щелочная - рН > 7
Гидролиз солей. Гидролизом соли называется взаимодействие ионов соли с водой, приводящее к образованию слабого электролита и (чаще всего, но не всегда) к избыточному содержанию в растворе ионов Н+ или ионов ОН-.
Различают 4 случая гидролиза:
1. Гидролиз по катиону характеризует соли, образованные сильной кислотой и слабым основанием. В этом случае катион соли связывает ионы ОН воды, что смещает равновесие системы Н2О Û Н+ + ОН- вправо. [H+] > [OH-] - среда кислая, рН < 7.
2. Гидролиз по аниону характеризует соли, образованные слабой кислотой и сильным основанием. В этом случае анион соли связывает ионы Н+ воды и в растворе накапливаются ионы ОН-. [OH-] > [H+] - среда щелочная, рН > 7.
3. Гидролиз по катиону и аниону - свойственен солям, образованным слабой кислотой и слабым основанием. Реакция растворов таких солей определяется соотношением величин констант диссоциации продуктов гидролиза.
4. Соли, образованные сильными кислотами и основаниями не содержат в своем составе ионов, способных к взаимодействию с водой, поэтому гидролизу не подвергаются.
Количественной оценкой гидролиза являются степень и константа гидролиза. Степенью гидролиза h называется отношение числа молекул, подвергшихся гидролизу, к общему числу растворенных молекул: h=cг/с. Степень гидролиза тем больше, чем больше Кw, т.е. чем больше температура (так как Кw возрастает с температурой); чем меньше Кдисс., т.е. чем слабее кислота (основание), которая образуется в результате гидролиза соли; чем меньше концентрация, т.е. чем больше разбавлен раствор.
Константой гидролиза Кг. называется отношение произведения концентраций продуктов гидролиза к концентрации негидролизованной соли. Для реакции CN- + HOH Û HCN + OH- константа гидролиза запишется в виде:

Величина Кгидр., в отличие от степени гидролиза, не зависит от концентрации раствора, поэтому является более удобной характеристикой процесса. Обе величины связаны между собой отношением:
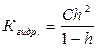
 При малых значениях h:
При малых значениях h:


Гетерогенные равновесия. Произведение растворимости. Абсолютно нерастворимых веществ нет. Поэтому ничтожная часть даже самого нерастворимого вещества, например AgCl, все же переходит в раствор. Со временем между твердой фазой (осадком) и ионами в растворе устанавливается подвижное равновесие:
AgCl (осадок) Û Ag+ + Cl- (раствор)
Таким образом, в гетерогенной системе, состоящей из осадка и насыщенного относительно него раствора, непрерывно протекают два процесса с одинаковой скоростью: переход ионов в раствор и их осаждение на поверхности кристаллов. Произведение растворимости - постоянная величина при данной температуре - представляет собой произведение концентраций ионов в насыщенном растворе малорастворимого электролита. Обычно его обозначают символом ПР с индексом, указывающим, к какому электролиту он относится, например [Ag+][Cl-] = ПРAgCl. Надо иметь ввиду, что ПР постоянно только для насыщенных растворов малорастворимых веществ (например AgI, BaSO4, но не NaCl). ПР характеризует растворимость вещества: чем больше ПР, тем больше растворимость.
При [Ag+][Cl-] < ПРAgCl - раствор ненасыщенный,
[Ag+][Cl-] = ПРAgCl - раствор насыщенный,
[Ag+][Cl-] > ПРAgCl - раствор пересыщенный.
Добавляя к ненасыщенному раствору электролита электролит с одноименным ионом, можно превратить его в насыщенный и пересыщенный. Из понятия ПР вытекает условие образования осадков: малорастворимый электролит всегда выпадает в осадок, когда произведение концентраций ионов сделается больше величины ПР электролита, т.е. в случае AgCl, когда [Ag+][Cl-] >> ПРAgCl. Это будет достигнуто прибавлением избытка электролита, содержащего Ag+ - или Cl- -ионы. Растворение осадка происходит тогда, когда произведение концентраций ионов сделается меньше величины ПР электролита, т.е. в случае AgCl, когда [Ag+][Cl-] << ПРAgCl.Этого можно достигнуть, связывая один из ионов, посылаемых осадком в раствор. Это осуществляется образованием: 1) малодиссоциированного соединения; 2) комплексного иона; 3) менее растворимого соединения; 4) изменением заряда иона в окислительно-восстановительной реакции.
Буферные растворы. Буферные растворы - это такие растворы, рН которых почти не зависит от разбавления, концентрирования и мало изменяется при прибавлении к ним небольших количеств кислот или щелочей, не превышающих некоторого предела. Обычно буферными являются растворы, содержащие слабую кислоту и ее соль, образованную сильным основанием, или слабое основание и его соль, образованную сильной кислотой. Буферной емкостью называется число эквивалентов N кислоты или основания, необходимое для смещения рН одного литра буферного раствора на одну единицу. Она вычисляется по формуле:

где рН0 - исходное значение, а рН1 - после добавления кислоты или щелочи. Буферная емкость раствора тем выше, чем больше концентрация компонентов и чем меньше эти концентрации отличаются друг от друга. Каждый буферный раствор имеет определенное значение рН, которое можно рассчитать, пользуясь соответствующими формулами.