Группа№23, химия,урок№94.
Тема программы: Стоение вещества.
Тема урока: Ионная связь, как частный случай ковалентной связи.
Цель урока: Рассмотреть ионную связь.
План.
Ионная связь.
2. Ковалентная связь.
Опорный конспект
Ионная связь.
Основные положения современной теории ионной связи:
1.) Ионная связь образуется при взаимодействии элементов, резко отличающихся друг от друга по свойствам, т. е. между металлами и неметаллами.
2.) Образование химической связи объясняется стремлением атомов к достижению устойчивой восьмиэлектронной внешней оболочки (s2p6).
Пример: Na + Cl2 = NaCl2
Na: 1s22s2p63s1 Na0 - 1e = Na+ Na+: 1s2 2s2p6
Cl: 1s22s2p63s2p5 Cl0 + 1e = Cl- Cl-: 1s22s2p6 3s2p6
3.) Образовавшиеся разноимённо заряженные ионы удерживаются друг около друга за счёт электростатического притяжения.
4.) Ионная связь не направленная.
5.) Не существует 100%-ной ионной связи, т. е. полностью атомы не отдают свои электроны другому атому.
Пример: Fr+0,93F-0,93 - 93%
FrF Fr+ + F- - при растворении. Ионная связь - частный случай ковалентной связи.
Ковалентная связь.
Основные положения современной теории ковалентной связи.
1.) Ковалентная связь образуется между элементами, сходными по свойствам, т. е. неметаллами.
2.) Каждый элемент предоставляет для образования связей 1 электрон, причём спины электронов должны быть антипараллельными.
3.) Если ковалентная связь образована атомами одного и того же элемента, то эта связь не полярная, т. е. общая электронная пара не смещена ни к одному из атомов. Если же ковалентная связь образована двумя разными атомам, то общая электронная пара смещена к наиболее электроотрицательному атому, это полярная ковалентная связь.
4.) При образовании ковалентной связи происходит перекрывание электронных облаков взаимодействующих атомов, в результате, в пространстве между атомами возникает зона повышенной электронной плотности, притягивающая к себе положительно заряженные ядра взаимодействующих атомов, и удерживающая их друг от друга
Список литературы
1. Габриелян О.С. Химия. Методическое пособие. 10-11 классы. М.: «Дрофа», 2005г.
2. Еремин В.В., Кузьменко Н.Е., Тренин В.И., химия. 10 класс: учебник для общеобразовательных учреждений(базовый уровень). – М.: Дрофа, 2009г.
3. Еремин В.В., Кузьменко Н.Е.,Дроздов А.А., химия. 11 класс: учебник для общеобразовательных учреждений базовый уровень). – М.: Дрофа, 2009г.
4. Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005
5. Рудзитис Г.Е., Фельдман Ф.Г, химия. 11 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005
Перечень цифровых образовательных ресурсов и Web-сайтов Интернет
1. https://school-collection.edu.ru/. - единая коллекция цифровых образовательных ресурсов:
Перечень Web-сайтов,рекомендуемых для использования в работе:
1. http//www.chem.msu.su/rus/school/ - сайт журнала «Химия: методика преподавания в школе»
2. https://www.chem.msu.su/rus/school/ - школьные учебники по химии для 8-11 классов общеобразовательной школы
3. https://c-books.narod/ru- литература по химии
4. https://experiment.edu.ru/catalog.asp- естественнонаучные эксперименты
5. chem.msu.su –портал фундаментального химического образования России
6.alhimik.ru – образовательный сайт по химии
Д.З. Изучите конспект и ответьте на вопросы:
Основные положения современной теории ионной связи?
Основные положения современной теории ковалентной связи?
Уважаемый студент сфотографируйте конспект и пришлите на электронный адрес
(dima.levchenko02@ramler.ru
Группа№23, химия,урок№95.
Тема программы: Стоение вещества.
Тема урока: Металлическая связь.
Цель урока: Рассмотреть металлическую связь.
План.
Металлическая связь.
Особенности металлической связи.
Опорный конспект.
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как повышенные температуры плавления, значительные электро- и теплопроводность, способность отражать свет и прокатываться в листы и имеют характерный металлический блеск. Эти свойства связаны с существованием в металлах металлической связи — связи между положительно заряженными ионами металлов. Металлическая связь возникает за счет притяжения свободно движущихся по кристаллу электронов.
Валентные атомные орбитали каждого атома металла перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей. Т.е. в кристаллической решетке металла перемещения электронов происходит свободно. Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно. Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
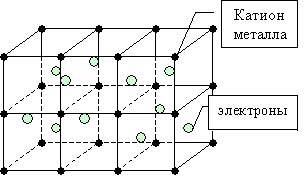
Металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов. Чем легче атом металла переходит в состояние иона, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов. В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
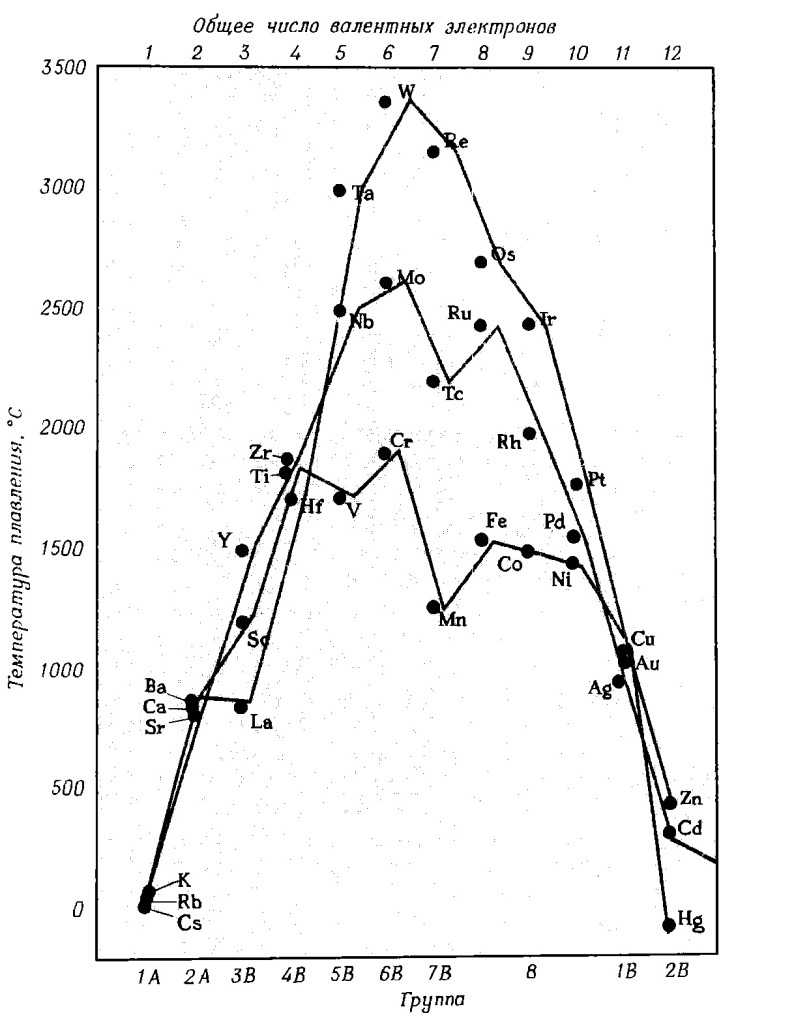
Зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Список литературы
1. Габриелян О.С. Химия. Методическое пособие. 10-11 классы. М.: «Дрофа», 2005г.
2. Еремин В.В., Кузьменко Н.Е., Тренин В.И., химия. 10 класс: учебник для общеобразовательных учреждений(базовый уровень). – М.: Дрофа, 2009г.
3. Еремин В.В., Кузьменко Н.Е.,Дроздов А.А., химия. 11 класс: учебник для общеобразовательных учреждений базовый уровень). – М.: Дрофа, 2009г.
4. Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005
5. Рудзитис Г.Е., Фельдман Ф.Г, химия. 11 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005
Перечень цифровых образовательных ресурсов и Web-сайтов Интернет
1. https://school-collection.edu.ru/. - единая коллекция цифровых образовательных ресурсов:
Перечень Web-сайтов,рекомендуемых для использования в работе:
1. http//www.chem.msu.su/rus/school/ - сайт журнала «Химия: методика преподавания в школе»
2. https://www.chem.msu.su/rus/school/ - школьные учебники по химии для 8-11 классов общеобразовательной школы
3. https://c-books.narod/ru- литература по химии
4. https://experiment.edu.ru/catalog.asp- естественнонаучные эксперименты
5. chem.msu.su –портал фундаментального химического образования России
6.alhimik.ru – образовательный сайт по химии
Д.З. Изучите конспект и ответьте на вопросы: