Лабораторная работа № 1
« Природные и искусственные сорбенты - фактор качества жизни и экологической безопасности ». Рекомендуются следующие варианты (и темы) лабораторной работы №1.
Тема №1а. Использование ионообменной хроматографии для очистки различных водных растворов от катионов и анионов.
В лабораторной работе № 1а студенты проводят очистку одного из водных растворов от ионов. Применяются стеклянные хроматографические колонки или стеклянные фильтры - Нутча (№ 2, 3, 4). Сорбенты: катионит КУ-2 в Н+ форме и анионит АВ-17 в CL- или ОН - формах.
Перед выполнением работы обсуждаются как теоретические аспекты кинетики, статики и динамики сорбции, так и практические аспекты данного метода: использование деионизированной воды в химии, экологии и медицине; разработка и применение метода сорбционных лизиметров.
Для более полного познания процессов сорбции веществ и ионов тяжелых металлов, в частности, в сорбционных лизиметрах, установленных в профиле почвы, необходимо проводить лабораторные исследования по их сорбции разными сорбентами. Целесообразно установить емкость сорбентов, чтобы правильно рассчитать их мощность в сорбционных колонках. Важно также подобрать и эффективные элюенты для вытеснения из массы сорбентов сорбированных ионов.
Рассмотрим эти вопросы.
Фракционирование смеси ионов с помощью их сорбции на ионитах
Цель работы: определение полной обменной емкости катионита КУ-2 в Н+ форме и разделение смеси катионов на ионообменной сорбционной колонке.
Теория вопроса
При проведении лизиметрических опытов с помощью метода сорбционных лизиметров нередко возникает ситуация, когда в лаборатории приходится, например, разделять смесь катионов на сорбенте или получить чистый раствор лимонной кислоты из лимоннокислого натрия. В этой связи рассматриваемая лабораторная работа имеет важное научно-практическое значение.
Реакции ионного обмена протекают на катионите в Н+ форме (1) и анионите в ОН- форме следующим образом:
RSO3-H+ + NaOH → RSO3-Na+ + Н2О (24)
RNH3-OH- + HCl → RNH3+Cl- + Н2О (25)
При статичном методе смолу, например катионит в Н+ форме, титруют раствором щелочи. При динамичном методе величина ПОЕ определяется в динамике (при протекании изучаемого раствора через столбик сорбента, расположенного в хроматографической колонке). Через сорбционную колонку, заполненную ионообменной смолой, пропускают раствор электролита и регистрируют зависимость концентрации поглощаемого иона в выходящем растворе (элюате) от объема прошедшего раствора (выходная кривая).
В данной работе величина ПОЕ сульфокатионита КУ-2 в Н+ форме определяется по количеству образовавшейся кислоты в элюате, в результате вытеснения из смолы ионов Н+ ионами Na+:
RSO3-H+ + Na+ + Cl- → RSO3-Na+ + Н+ + Cl- (26)
ПОЕ сорбента рассчитывают по формуле (4):
ПОЕ =  (27)
(27)
где Vобщ ─ суммарный объем раствора, содержащий
вытесненную из смолы кислоту (ионы Н+);
с ─ концентрация кислоты (ммоль/л);
m ─ масса ионообменной смолы в колонке (г).
В реальных почвенных условиях равновесие не успевает полностью установиться вследствиемедленной диффузии ионов в частицах почвы, что приводит к размытию хроматографической зоны. Весьма четко диффузное размытие выражено в почвах, испытывающих оглеение. Здесь обычно выражена сегрегация ионов закисного железа (образование конкреций при длительном подсыхании почвы).
Выражение (7) можно преобразовать следующим образом:
 V max = vτ max;
V max = vτ max; 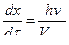 (28)
(28)
где V max и τ max ─ объем протекающего через колонку раствора и время, отвечающее максимуму выходной кривой (мл и с);
h ─ длина колонки, см.
При малых концентрациях иона М z + и постоянной концентрации кислоты производную 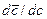 можно заменить на отношение конечных величин
можно заменить на отношение конечных величин  и считать концентрацию ионов водорода в смоле [H+] равное ПОЕ. Тогда:
и считать концентрацию ионов водорода в смоле [H+] равное ПОЕ. Тогда:
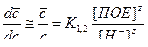 (29)
(29)
Из уравнений (6) ─ (9) следует:
K 1,2 =  (30)
(30)
Значение Vmax находят с учетом поправки на свободный объем ко лонки Vо:
Vmax = V*max ─ Vo (31)
где V*max ─ объем элюата, вышедшего из колонки от начала элюирования М2+ в элюате (максимум на выходной кривой).
При хроматографическом разделении ионов широко используется различная их склонность к образованию комплексных соединений. Эту особенность следует учитывать и использовать в экспериментальной работе.
Например, кобальт и медь могут быть разделены в колонке с сульфокатионитом при помощи десорбента ─ раствора цитрата калия (лимоннокислый калий). Если пропустить через катионит в К+ форме раствор, содержащий небольшое количество разделяемых элементов без органических лигандов, то ионы кобальта и меди поглощаются в верхнем слое смолы. Разделить кобальт и медь динамическим методом, промывая колонку раствором, содержащим ионы K+, трудно, так как константы обмена ионов Со2+ и Cu+ на ион K + отличаются не намного.Если через колонку пропускать раствор цитрата калия (десорбент), то при контакте его со смолой происходит частичная десорбция меди и кобальта вследствие реакций комплексообразования, например:
(RSO2-)2 М2+ + 2K+ + А3- ↔ 2RSO3-K+ + [MA]- (32)
где А3 ─ комплексообразующий анион лимонной кислоты.
С лимонной кислотой ионы кобальта и меди образуют несколько различных комплексных соединений [MA]-, [MA2]4- и другие, которые не адсорбируются на катионите.
Таким образом, в присутствии органических лигандов (моно,- би,- три,- и полициклических) уменьшается концентрация катионов Со2+ и Cu2+, способных сорбироваться на катионите, и возрастает дóля несорбирующихся комплексных Со и Cu. При фильтрации через слой сорбента вытеснителя (цитрата калия) происходит многократная сорбция-десорбция разделяемых ионов, причем катионы меди, образующие более устойчивые комплексы [R-Cu]4- передвигаются вниз по слою ионита с бóльшей скоростью и отделяются от аналогов кобальта. В результате образуются различные по окраске зоны: голубая для Cu и оранжевая для Со.
Указанные положения теории иообменной сорбции в той или иной мере рассматривались нами ранее при изучении трансформации в сорбционных лизиметрах известковых мелиорантов и мобилизации в раствор ионов кальция и ряда тяжелых металлов. В полевых опытах было показано, что преимущественно ионы кальция и часть массы ионов тяжелых металлов не сорбируются катионитом КУ-2 и в заметных количествах проникают в приемник лизиметрических вод. Таким образом, их форма миграции в профиле почвы становится более определенная – анионная, с отрицательным знаком заряда
Порядок выполнения работы
«Разделение смеси ионов Cu2+ и Со2+ на катионите КУ-2 в водном растворе».
Для проведения работы необходимы:
─ Хроматографическая колонка с ионообменной смолой КУ-2,
─ Фотоэлектрический колориметр (ФЭК 56М),
─ Градуированные пробирки,
─ Стакан емкостью 50 мл,
─ Раствор соли кобальта (II) и соли меди (II),
─ 3 М раствор HCl,
─ 1,5 М раствор KCl,
─ Раствор, содержащий 0,15 моль/л однозамещенного цитрата калия и 0,15 моль/л двузамещенного цитрата калия.
Катионит предварительно переводят в K+ форму (см. определение ПОЕ смолы КУ-2). Для этого через колонку со скоростью 2 капли в 1 с пропускают последовательно растворы: 20 мл 3 М HCl, 40 мл 1,5 М KCl, 20 мл Н2О. Затем около 4 мл разделяемой смеси ионов меди и кобальта пропускают через смолу и колонку промывают небольшим количеством (15-20 мл) воды. При этой операции ионы Cu2+ и Со2+ поглощаются в верхней части катионита (этот слой приобретает бурую окраску). В небольшую емкость над хроматографической колонкой наливают раствор цитрата калия, постепенно открывают кран колонки и собирают элюат в пробирки по 4,0-4,5 (5,0) мл. Скорость элюирования должна соответствовать 1 капле в 1 с.
Периодически добавляют раствор десорбента и проводят элюирование до полного выхода кобальта из колонки, о чем свидетельствует исчезновение оранжевой окраски элюата. С помощью фотоэлектроколориметра измеряют оптическую плотность D каждой порции элюата со светофильтром 480 нм (для определения содержания кобальта). Методика определения оптической плотности приведена ниже, а в таблицу заносятся результаты опыта. В качестве раствора сравнения используют дистиллированную воду. По калибровочным графикам, построенным с применением стандартных растворов солей меди и кобальта, находят концентрации Cu2 и Со2+ в каждой пробе.
Полученные данные записывают в таблицу 6 и строят выходную кривую фракционирования ионов Cu2+ и Со2+.
Табл. 6. Экспериментальные данные по сорбционному разделению Cu2+ и Со2+ на катионите КУ-2 в динамике
| Номер пробы | Объем пробы, мл | D при 620 нм | [Cu2+], г/л | D при 480 нм | [Co2+], г/л | Объем элюата V, мл |
Порядок работы на приборе ФЭК-56М
Включают фотоэлектроколориметр и «прогревают» его в течение ~ 30 мин. Устанавливают электрический нуль прибора, для чего рукояткой на верхней панели прибора световые лучи перекрывают шторкой (рукоятка в правом положении) и рукоятками «нуль» на левой панели устанавливают стрелку микроамперметра на «О». Правый луч ─ измерительный, а левый ─ компенсационный.
На пути левого светового луча устанавливают кювету, заполненную дисперсионной средой (водой). В правый кюветодержатель помещают две кюветы: одну с растворителем (Н2О), другую ─ с исследуемым раствором. Вращая рукоятку на правой панели прибора на пути правого светового луча устанавливают кювету с раствором. Индексы правого и левого барабанов устанавливают на «О» по шкале оптической плотности (нанесена красными цифрами). Затем шторку, перекрывающую световые лучи, переводят в положение «открыто». Вследствие поглощения или рассеяния света исследуемой системой стрелка микроамперметра будет отклоняться от нулевого положения. Вращая барабан левой раздвижной диафрагмы, стрелку микроамперметра возвращают на «О» (уравнивают интенсивности обоих световых потоков). Затем поворотом рукоятки на правой панели прибора по ходу правого луча устанавливают кювету с дисперсионной средой. При этом стрелка микроамперметра, установленная на «О», смещается, так как фотометрическое равновесие снова нарушается. Вращением правого барабана добиваются первоначального нулевого положения стрелки и отсчитывают по шкале правого барабана значение оптической плотности исследуемой системы.
Определение полной обменной емкости (ПОЕ) катионита
КУ-2 в Н+ форме в динамике
Для проведения работы необходимы:
─ Хроматографическая колонка, заполненная 5 г смолы КУ-2,
─ рН - метр марки рН-340,
─ Градуированные пробирки,
─ Мерный цилиндр емкостью 250 мл,
─ Стакан емкостью 50 мл,
─ Бюретка,
─ 3 М раствор HCl,
─ 1,5 M раствор NaCl,
─ 0,2 M раствор KOH,
─ Фенолфталеин.
Ход эксперимента
В работе используется хроматографическая колонка, устройство которой изображено на рис. 2. Рабочий объем колонки 5, представляющий трубку с внутренним диаметром 10 мм и высотой 200 мм, заполнен сульфокатионитом КУ-2 с размером зерен 0,4-0,6 мм. Емкость 2 для элюента соединена с рабочим объемом колонки трубкой 4, благодаря которой создается избыточное гидростатическое давление, необходимое для прохождения раствора через слой ионита. Тонкий стеклянный стержень 3 способствует заполнению трубки раствором. Скорость пропускания раствора регулируется краном 6.
Табл. 7. Определение величины ПОЕ катионита КУ-2 в динамике
| № пробы | Объем пробы, мл | рН пробы | Суммарный объем элюата |
Все растворы, содержащие вытесненную из смолы кислоту (остатки элюата в пробирках, растворы из кюветы рН-метра, вода после промывки пробирок и кюветы рН-метра), объединяют, сливают в мерный цилиндр и измеряют Vобщ. Из этого общего объема пипеткой отбирают аликвоту (10 мл), переносят в плоскодонную колбу и титруют 0,2 М водным раствором КОН в присутствии индикатора фенолфталеина. Определяют концентрацию кислоты. Затем рассчитывают величину ПОЕ катионита в мг-экв на 1 г ионита по формуле:
ПОЕ = 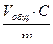 (33)
(33)
Если определяется полная динамическая обменная ёмкость (ПДОЕ) катионита по отношению к ионам металла, допустим Zn2+, то эту аналитическую операцию рассмотрим на следующем примере.
Пример: Определить ПДОЕ катионита КУ-2 (моль/г), если известно, что через сорбционную колонку, содержащую 5,0 г сорбента, пропустили 250 мл 0,05 М водного раствора ZnSO4, а вытекающий из колонки элюат последовательно собрали в 5 колбочек по 50 мл и определили в них концентрации ионов Zn2+ моль/л: в 1-й ─ 0,008, во 2-й ─ 0,029; в 3-й ─ 0,038; 4-й ─ 0,050 и 5-й ─ 0,05.
Решение. Вычисляем количество эквивалентов Zn2+, поглощённое из каждой порции раствора, принимая молярную массу эквивалента равной М (1/2Zn2+). Получим для пяти порций элюата:
1-япорция: 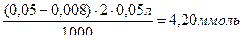 (34)
(34)
2-я порция: 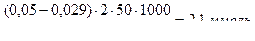 (35)
(35)
3-я порция: 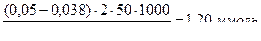 (36)
(36)
4 и 5-я пробы не содержали ионов Zn2+. Всего в 5-ти порциях раствора было обнаружено ионов цинка: 4,2 + 2,1 + 1,2 = 7,5 ммоль Zn2+ (1/2).
Отсюда ПДОЕ катионита КУ-2 равна: 7,5/5 = 1,5 ммоль/г сорбента.
Выводы по работе:1. В отличие от химического подхода при эколого-геохимическом в лабораторной работе предватительно рассматриваются особенности организации стационарных наблюдений в ландшафтах. Это позволяет студентам полнее познать ландшафтную ситуацию и целенаправленно проводить лабораторные исследования; 2. Поскольку при изучении процессов трансформации и водной миграции веществ в почвах агроландшафтов часто используется метод сорбционных лизиметров, понятна актуальность проведения лабораторных опытов по изучению сорбции-десорбции веществ целевыми сорбентами; 3. Изучены особенности сорбции ряда ионов тяжелых металлов на катионите КУ-2 в Н+ форме; 4. Установлена своеобразная роль органических лигандов в комплексообразовании с ионами кобальта и меди и слабая сорбция их устойчивых (и водорастворимых) органо-минеральных комплексов катионитом КУ-2 в Н+ форме; 5. В этой связи в сорбционных лизиметрах при исследовании миграции ионов металлов наряду с ионитами следует применять и другие сорбенты.
Контрольные вопросы при защите лабораторной работы № 1
1. Охарактеризуйте реакцию ионного обмена в водном растворе между катионами кальция и ионами водорода катионита КУ-2,
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Напишите реакцию ионного обмена между цитратом меди и ионами калия, сорбционно закрепленными на катионите КУ-2,
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Для каких целей в сорбционных лизиметрах используется катионит КУ-2 в Н+ форме?
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Каким образом можно определить полную динамическую емкость сорбента (катионита КУ-2)?
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. В сорбционных лизиметрах используется произвольная или определенная масса сорбента? _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
6. Какую роль играют низкомолекулярные органические кислоты почв тайги в сорбции ионов металлов (в том числе и тяжелых) катионитом КУ-2 в сорбционных лизиметрах?
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
7. Объясните, как определить необходимую массу того или иного сорбента для сорбционного лизиметра?
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вопросы для самоконтроля по теме 2а
1. Какие методы используются для глубокой очистки природной воды?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Какие сорбенты применяют для очистки природных вод от соединений железа?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Какие сорбенты применяют для глубокой очистки природных вод от водорастворимых органических веществ с кислотными свойствами?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Какие методы применяют для дезинфекции природных вод перед водопотреблением?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
5. Для каких целей проводят центрифугирование и диализ природной воды?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
6. С какой целью проводят озонирование и известкование природных вод перед водопотреблением?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Приведите примеры возможных химических реакций в подзолистых почвах
1. Взаимодействие частиц СаСО3 с органической кислотой в составе ВОВ:
2. Взаимодействие частиц кальцита с гидрозолем гидроксида железа:
3. Взаимодействие частиц СаСО3 с угольной кислотой:
Объясните, почему органические кислоты и фульвокислоты подзолистых почв тайги химически более активны в сравнении с Н2СО3?__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Тема № 2а
«Аналитическая технология глубокой очистки воды от примесей, ионов, коллоидов, органических лигандов, экотоксикантов, болезнетворных микроорганизмов, вирусов и простейших паразитов».
Экологи, токсикологи и гидрохимики отмечают, что в водных источниках заметно возросла концентрация различных возбудителей заболеваний. Это связано с изменением гидрохимического состава поверхностных природных вод и микробиологическим загрязнением за счет привноса бытовых стокови фекальных масс. Известно, что в бытовых и сточных водах встречаются микроорганизмы, вызывающие инфекционные (и эпидемиологические) заболевания: дизентерию, брюшной тиф, гепатит, лямблиоз, сальмонеллез. Из кишечника и моче – половых путей человека выделяется более 100 видов вирусов, которые проходят через простые очистные сооружения и попадают в водоемы. В курортных городах подобные стоки очень часто сбрасываются вблизи пляжей неочищенными в морской бассейн. Коммунальные службы, по-видимому, предполагают их естественную дезинфекцию и самоочищение в соленой воде. Однако на мелководье, даже в морской воде, инфекция сохраняется довольно длительное время, достаточное для заражения людей (туристов и отдыхающих) в жаркие летние месяцы курортного бума, особенно в тропиках и субтропиках. Установлено, например, что за сутки больной или инфицированный человек выделяет 2-7 x 10 8 шт. болезнетворных микробов, а в 1г фекалий содержится в среднем 2000 тыс. цист лямблий. Этот пример наглядно показывает, с одной стороны, насколько важен здесь экологический мониторинг за эко-токсикологическим состоянием почв, стоков и природных вод, а с другой – какие высокие требования должны предъявляться к обеззараживанию и очистке сточных вод.
Методы, используемые при очистке и дезинфекции природных вод
Промышленные сточные воды зачастую биологическим путем не очищаются, поэтому существенное значение имеет их локальная физико-химическая обработка до сброса в общегородской коллектор. Бытовые сточные воды обычно хлорируют, озонируют, обрабатывают пероксидом водорода (это экологически «чистый» окислитель), а также подвергают воздействию УФ - света и гамма-излучению.
Хлорирование – один из самых распространенных методов дезодорации сточных и бытовых вод. Несмотря на простоту и компактность установок для хлорирования, доступность и дешевизну хлора и его производных (CLO 2, HOCL…) очистка воды активным хлором может иметь ограниченное применение. Связано это с недостаточной глубиной окисления растворимых органических веществ (нативных и искусственных), образованием токсичных хлорорганических соединений, необходимостью применения высоких доз хлора, токсичностью самого реагента – хлора.
Озонирование – технологический прием, при котором происходит одновременное окисление органических веществ, растворенных в воде, обесцвечивание, дезодорация, обезвреживание стоков и насыщение воды кислородом. Озон используется также для очистки вод от цианидов, роданидов, сероводорода, мышьяка и иных экотоксикантов, а также от гумусовых веществ, пестицидов, фенолов и углеводородов. Озон эффективен при водоподготовке питьевых вод. Озон представляет собой модификацию О 2 , но сильно от него отличается: он интенсивно окрашен, токсичен и взрывоопасен. ПДК для озона в рабочей зоне составляет 0,0001 мг/л. Эффективность использования озона резко возрастает в присутствии сорбентов, например, активированного угля.
Пероксид водорода – по сравнению с озоном имеет следующие преимущества: он хорошо растворим в воде, устойчив в водных растворах, окисляет широкий спектр органических соединений при различных величинах pH, нетоксичен. В силу своих технологических преимуществ H 2 O 2 нашел широкое применение в зарубежной практике очистки сточных и бытовых вод. Метод отличает дефицит реагента и его высокая стоимость. Вернемся к теме № 2.
Предлагаемая лабораторная работа включает ряд этапов на пути использования физико-химических методов и обеззараживания воды:
первый - отстаивание, аэрация, озонирование и обработка Н2О2;
второй – коагуляция коллоидов кремния, железа, алюминия, марганца…коагулянтами, а также флокуляция и флотация;
третий – центрифугирование;
четвертый - фильтрация и ультрафильтрация;
пятый- сорбция растворимых (ионно-молекулярных) форм химических соединений различными сорбентами: оксидом алюминия, активированным углем, порошком кальцита (или доломита).
В теоретической части работы особое внимание уделяется свойствам активированных углей - уникальным поглотителям различных классов веществ из водных растворов, а также анализу математических уравнений изотерм сорбции – по Лэнгмюру, Фрейндлиху, Генри…
Литература: А.А. Лурье «Хроматографические материалы». М. Химия. 1978.
Лабораторная работа № 2
Изучение влияния компонентов «кислотных дождей» на экологическое состояние и функции почв таежных (и иных) экосистем
Вопросы для самоконтроля
1. Как возникают в ландшафтах «кислотные дожди»? Какие компоненты они содержат?
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Как влияют «кислотные дожди» на компоненты почвы?
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Могут ли улучшать почвенное плодородие агроэкосистем «кислотные дожди»?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Какие технологические методы можно рекомендовать для уменьшения масштаба «кислотных дождей»?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Что происходит при контакте «кислотных дождей» с гумусовыми веществами почвы?
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
6. Что такое техногенная кислотность ландшафтов?
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
7. Объясните термин «биогенная кислотность» таежной экосистемы.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
В теоретической части работы рассматривается химическое воздействие водных растворов некоторых минеральных кислот (H2SO4, HCL, HF, HNO3…) на состав обменных катионов почв подзолистого типа, емкость поглощения и свойства почвенно-поглощающего комплекса (ППК), кислотность почвы и подвижность гумусовых соединений. Отмечаются функции и роль ионов водорода и алюминия в формировании свойств почв подзолистого типа.
Лабораторные опыты проводятся в статике и динамике (в хроматографических колонках) с образцами почв, известняка и сорбентов. Техника постановки опытов может быть заимствована из предыдущих лабораторных работ.
Студентам предлагается самостоятельно провести эксперимент по влиянию водных растворов сильных минеральных кислот на ППК подзолистой почвы и чернозема выщелоченного (учхоз «Муммовское» Саратовская область). Определить концентрации в элюатах ионов кальция и мобильного гумуса.
Сделать экологические выводы: в чем отличие, например, воздействия слабых водных растворов азотной и серной кислот на почвы?
Лабораторная работа № 3
Тема: «Оценка экологических функций мобильных гумусовых соединений в экосистемах тайги».
Данная работа реализуется по следующим направлениям (по выбору студентов или предлагается преподавателем):
а) мобильные гумусовые соединения как дополнительные источники ионов водорода (гидроксония) в почвах;
в) мобильные гумусовые вещества как уникальные природные лиганды, играющие важную роль в комплексообразовании;
с) мобильные гумусовые вещества, участвующие в окислительно-восстановительных реакциях;
d) роль мобильных гумусовых веществ в трансформации и водной миграции ионов металлов в почвах таежной зоны.
Студентам выдаются задания по указанным выше вопросам. Предлагается самостоятельно дать им теоретическое обоснование и наметить план выполнения лабораторной работы.
Вопросы для самоконтроля
1. Объясните экологические функции мобильных групп гумусовых соединений (в частности, фульвокислот) в экосистемах тайги.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________Назовите основные процессы формирования мобильных групп гумусовых веществ в таежных экосистемах.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Охарактеризуйте основные компоненты, входящие в состав мобильных гумусовых соединений.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Объясните, почему в составе мобильных гумусовых соединений почв тайги содержатся органические вещества кислотной природы?
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Какую роль играют органические кислоты в функционировании таежной экосистемы?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Охарактеризуйте аналитическую схему W. Forsyth – И.М. Яшина (1974), используемую для фракциониро