Разрушение Ме в среде электролита с возникновением внутри системы электрического тока. Она может протекать:
- в электролитах (водных растворах солей, кислот, щелочей)
- в морской воде
- в атмосфере влажного воздуха
- во влажном грунте
| 2Н+ + 2е = Н2 |
(в нейтральных, щелочных средах)
O2 + 4H+ + 4e → 2H2O
(в кислых средах)
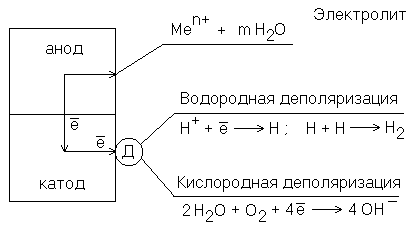
Рисунок – Схема электрохимической коррозии.
Д – деполяризатор
При электрохимической коррозии происходит образование местных гальванических пар. Участки с более отрицательным потенциалом являются анодными, а с более положительным – катодными. Поток электронов направлен от анодного к катодному участку и корродирует Ме анода. На анодных участках происходит окисление Ме и ионы Ме переходят в раствор: Ме – nе → Меn+; на катодных – восстановление окислителя. Ионы или молекулы, которые восстанавливаются при протекании катодного процесса, называются деполяризаторами.
Если коррозия протекает в кислой среде, то на катоде восстанавливаются ионы водорода (водородная деполяризация).
Если коррозия протекает во влажном воздухе, в электролите, содержащем растворенный кислород, при неравномерной аэрации, то на катоде восстанавливаются молекулы кислорода (кислородная деполяризация).
Рассмотрим коррозию железной пластинки с примесями меди в кислой среде. В этом случае железо будет анодом (E°= – 0,44В), а медь – катодом (E°= +0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризации ионами водорода, которые присутствуют в электролите:
А: Fe – 2e → Fe2+ – окисление
К: 2H+ + 2e → H2↑ – восстановление
Схема возникающего гальванического элемента выглядит следующим образом:
A (–) Fe | HCl | Cu (+) К
или
A (–) Fe | H+ | Cu (+) К
Во влажном воздухе:
(А) Fe – 2e → Fe2+ – окисление
(К) 2H2O + O2 + 4e → 4OH– – восстановление
Схема гальванического элемента:
А (–) Fe | H2O, O2 | Cu (+) К
У поверхности металла в электролите протекают следующие реакции:
Fe2+ + 2OH– → Fe(OH)2
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Коррозия металла в результате неравномерного доступа кислорода. При неравномерном доступе кислорода к Ме-ой поверхности, покрытой влагой, например каплей воды, образуется особая гальванопара: участок, к которому доступ кислорода затруднен будет анодом, где происходит окисление Ме, а участок, в большей степени покрытый кислородом окажется катодом (происходит восстановление кислорода).

Рисунок. Коррозия железа под каплей воды
Т.о. при электрохимической коррозии поток электронов направлен от более активного Ме (с меньшей величиной электродного потенциала) к менее активному проводнику (с большей величиной электродного потенциала) и более активный Ме корродирует. Скорость коррозии тем больше, чем дальше расположены друг от друга в ряду стандартных электродных потенциалов Ме, из которых образовался гальванический элемент.
Случаи электрохимической коррозии:
Атмосферная коррозия – это коррозия во влажном воздухе при обычной температуре. Поверхность Ме покрывается пленкой влаги, содержащей кислород. В этой пленке и протекает коррозия с кислородной деполяризацией. Обычная гальванопара Fe-C.
Почвенная коррозия – угрожает трубопроводам, оболочкам кабелей и всем подземным сооружениям. В этом случае Ме соприкасается с влагой почвы, содержащей кислород.
Электрическая коррозия, или электрокоррозия вызывается блуждающими токами, исходящими от трамвая, метро, электрических железных дорог. Блуждающие токи разрушают подземные Ме сооружения, электрокабели и т.д.
Защита от коррозии
Важнейшими из них являются: защита поверхности Ме покрытиями, создание сплавов с антикоррозионными свойствами, электрохимические методы, изменение состава среды, легирование Ме.

Легирование Ме. При легировании в состав сплава, например, стали вводят компоненты, вызывающие пассивность Ме (например, никель, хром, ванадий, титан).
Защитные покрытия. Материалами для Ме покрытий могут быть Ме (цинк, кадмий, алюминий, никель, хром), их сплавы (бронза, латунь), а также неМе покрытия (лаки, краски, эмали). По характеру поведения Ме покрытия делят на катодные и анодные.
К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. В качестве примера может служить луженое железо (железо покрыто слоем олова) При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия — катодом, на котором выделяется водород или поглощается кислород. Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждений покрытия.
Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером может служить оцинкованное железо. В этом случае основной металл (железо) будет катодом коррозионного элемента, поэтому он не корродирует.
Электрохимические методы (Протекторная защита и электрозащита). Эта защита применяется в тех случаях, когда защищаемая конструкция находится в среде электролита (морская вода, подземные, почвенные воды). Она осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала — протектора (в качестве материала протекторов используют сплавы алюминия, магния и цинка), а также катодной (катодная защита) или анодной (анодная защита) поляризацией за счет извне приложенного тока. Наиболее применима электрохимическая зашита в коррозионных средах с хорошей ионной электрической проводимостью. Катодная поляризация (защита) используется для защиты от коррозии подземных трубопроводов, кабелей. Катодную защиту применяют также к шлюзовым воротам, подводным лодкам, водным резервуарам, буровым платформам, морским трубопроводам и оборудованию химических заводов.
Изменение свойств коррозионной среды. Для снижения arpecсивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например, в нейтральных средах коррозия обычно протекает с поглощением кислорода. Его удаляют деаэрацией (кипячение, барботаж инертного газа) или восстанавливают с помощью соответствующих восстановителей (сульфиты, гидразин и т. п.) Например, О2 + N2H4 = N2 + 2H2O. Агрессивность среды может уменьшаться также при снижении концентрации ионов Н+, т. е. повышении рН (подщелачивании).
Для защиты от коррозии широко применяют ингибиторы (нитраты, нитриты, органические вещества - уротропин). Ингибитором называется вещество, при добавлении которого в небольших количествах в среду, где находится металл, значительно уменьшается скорость коррозии металла. Ингибиторы применяют главным образом в системах, работающих с постоянным или мало обновляемым объемом раствора, например в некоторых химических аппаратах, системах охлаждения, парогенераторах и т. п. Они применяются при транспортировке газа и нефти, для защиты от коррозии горюче-смазочными веществами, а также в органических средах, морской воде и т. д.
Рациональное конструирование изделий должно исключать наличие или сокращать число и размеры особо опасных, с точки зрения коррозии, участков в изделиях или конструкциях (сварных швов, узких щелей, контактов разнородных по электродным потенциалам металлов и др.), а также предусматривать специальную защиту металла этих участков от коррозии.