Электрохимические процессы.
Химические свойства металлов.
Механизм возникновения электродного потенциала
В узлах металлической кристаллической решетки располагаются положительно заряженные ионы, находящиеся в равновесии со свободными электронами. При погружении металла (Ме) в раствор полярные молекулы воды притягиваются к положительно заряженному катиону Ме. В результате этого катион Ме может оторваться от кристаллической решетки и перейти в раствор в виде гидратированного иона. При этом на поверхности Ме скапливаются избыточные электроны. Это процесс можно выразить уравнением:
Me + mH2O ↔ Me n+ · m H2O + nē,
в растворе на
металле
где n – число электронов, принимающих участие в процессе.
Гидратированные катионы Ме, находящиеся в растворе, притягиваются к отрицательно заряженной поверхности Ме, поскольку на нем появляется избыток электронов, в результате чего образуются два слоя с противоположными зарядами - двойной электрический слой, характеризующийся определенным скачком потенциала - электродным потенциалом.
а) р-р б)
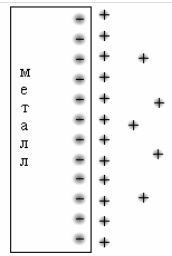
Рисунок 1 – Схема двойного электрического слоя (а);
распределение заряда в объеме электролита (б)
Электродному потенциалу приписывают тот знак, который имеет поверхность Ме.
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
Уравнение Нернста
Электродный потенциал каждого электрода зависит от природы Ме, концентрации (активности) ионов в растворе и температуры. Эта зависимость определяется по уравнению Нернста:
Е Меn+/ Ме0 = Е0 Меn+/ Ме0 + 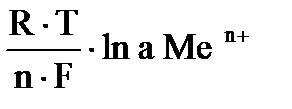 ,
,
где Е Меn+/ Ме0 - электродный потенциал;
Е0 Меn+/ Ме0 – стандартный электродный потенциал;
R – газовая постоянная (8,31 Дж/моль*К);
Т – температура (298 K);
F – число Фарадея (96496 Кл/моль);
n – число электронов, участвующих в электронной реакции;
а – активная концентрация ионов металла в растворе.
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T, а также заменив активность на молярную концентрацию, получим удобную для расчетов форму уравнения Нернста:
Е Меn+/ Ме0 = Е0 Меn+/ Ме0 + 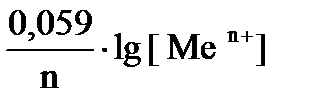
Значения стандартных электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях.
Стандартный водородный электрод состоит из стеклянного сосуда, заполненного 2Н (двунормальным) раствором H2SO4, в котором активность ионов Н+ равна единице 1 (1 моль/л). В этот раствор погружен электрод из платины, покрытый мелкодисперсной платиновой чернью для увеличения поверхности. При использовании водородного электрода через раствор H2SO4 пропускают химически чистый газообразный водород под давлением 100 кПа при T = 298 K.
Поскольку потенциал стандартного водородного электрода равен нулю, то измеренное напряжение будет представлять собою потенциал данного электродного процесса.
Таким образом, стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор, в котором концентрация (или активность) собственных ионов равна 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 298 К условно принимается равным нулю. Стандартный потенциал обозначают буквой j° (или Е°) с указанием электрода, который записывают следующим образом: сначала потенциал – определяющие ионы, находящиеся в растворе, а затем материал электрода, например стандартный электродный потенциал цинка Е 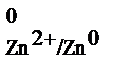 .
.
В зависимости от значения стандартного электродного потенциала все Ме можно расположить в ряд стандартных электродных потенциалов (ряд активности). Чем меньше потенциал металла, тем активнее этот металл и выше его восстановительная способность.
Химические свойства Ме
(взаимодействие со сложными веществами)
1) Взаимодействие с водой (окислитель Н+). При обычных условиях щелочные и щелочноземельные металлы вытесняют водород из воды, образуя при этом растворимое основание. Остальные металлы, расположенные в ряду активности от магния до водорода, на поверхности имеют защитную оксидную пленку, которая практически не растворяется в воде и предохраняет металл от взаимодействия.
Например: Ca0 + 2H+20 = Ca+2(OH)2 + H20↑
2) Взаимодействие с разбавленными кислотами (искл. разб. азотная кислота) (окислитель Н+). В этих кислотах растворяются Ме, стоящие в ряду активности до водорода.
Mg + 2HCl = MgCl2 + H2
Однако проявляется пассивация свинца (возникает из-за того, что образующийся в начале реакции хлорид свинца (II) трудно растворим в воде и, оставаясь на поверхности Ме, защищает его от доступа новых порций кислоты):
Pb + 2HCl = PbCl2↓ + H2 ↑
3) Взаимодействие с разбавленной азотной кислотой
HNO3 (разб.) (окислитель NО3-)
восстанавливается до следующих продуктов:
Активные Ме (Li-Al) N2,
очень разб. NH3 , NH4NO3
Ме средней активности (Al-Н2)
Малоактивные (Н2-Au) NO
Примеры:
5Ca + 12HNO3 (разб) = 5Ca(NO3)2 + N2 + 6H2O
4Zn + 10HNO3 (очень разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
4) Взаимодействие с концентрированной азотной кислотой
восстанавливается до следующих продуктов:
Активные Ме (Li-Al) N2O
Ме средней активности (Al-Н2)
Малоактивные (Н2-Au) NO2
не реагирует с Al, Cr, Fe, Au, Pt, Ir (пассивация Ме)
Примеры:
4Ca + 10HNO3 (конц.) = 4Ca(NO3)2 + N2O + 5H2O
Ag + 2HNO3 (конц) = AgNO3 + NO2 + H2O
5)
H2SO4 (конц) (окислитель SO42-)
восстанавливается до следующих продуктов:
Активные (Li-Al) H2S
Средней активности (Al-Н2) S
Малоактивные (Н2-Au) SO2