После открытия Резерфордом атомного ядра многочисленные эксперименты подтвердили, что ядра атомов, так же, как и сами атомы, имеют сложную структуру. Одним из подтверждением этого является естественная радиоактивность, о которой мы говорили на прошлом уроке. Вспомним, что радиоактивностью мы назвали способность атомов некоторых химических элементов к самопроизвольному излучению.
Вторым подтверждением того, что атомы химических элементов имеют сложное строение, явилось открытие радиоактивного распада. Так называют превращения атомных ядер одного химического элемента в ядра атомов другого химического элемента, сопровождающееся испусканием частиц.
Примечательно, что ядерные реакции были открыты до того, как было установлено существование атомных ядер. Ещё в 1903 году Эрнест Резерфорд и его помощник, английский химик Фредерик Содди, обнаружили, что в результате α-распада радиоактивный радий превращается в новый химический элемент — радон.

При этом оба химических элемента не имеют ничего общего друг с другом: радий — это металл, который при нормальных условиях находится в твёрдом состоянии, а радон — это инертный газ. Помимо этого, атомы обоих элементов имеют разную массу, заряд ядра и количество электронов в электронной оболочке. Плюс ко всему, они по-разному вступают в химические реакции.
Вскоре опыты, проведённые с другими радиоактивными элементами, показали, что не только при α-излучении, но и при β-распаде происходит превращение одного химического элемента в другой. Однако механизм обоих превращений не был понятен вплоть до 1911 года. Лишь после того, как Резерфордом была предложена ядерная модель атома, стало понятно, что именно ядро претерпевает изменения при радиоактивных превращениях.
На самом деле, α-излучение — это поток атомов гелия, потерявших оба своих электрона, и их нет в электронной оболочке атома. А при β-излучении испускаются электроны, но уменьшение числа электронов в атоме превращает его в ион того же элемента, но не в новый химический элемент с другими физическими и химическими свойствами.
Посмотрите, как записывается реакция альфа-распада ядра атома радия с превращением его в ядро атома радона:

Число, которое стоит вверху перед буквенным обозначением ядра, называется массовым числом, а внизу — зарядовым числом (или атомным номером).
Массовое число ядра атома обозначается большой буквой А. Оно с точностью до целых чисел равно числу атомных единиц массы, содержащихся в массе ядра данного химического элемента.
Одна атомная единица массы — это внесистемная единица массы, которая применяется для масс молекул, атомов, атомных ядер и элементарных частиц. Она определяется как 1/12 часть массы свободного покоящегося атома углерода.
Зарядовое число ядра атома обозначается большой латинской буквой Z. Оно равно числу элементарных электрических зарядов, содержащихся в заряде ядра данного химического элемента.
Напомним, что под элементарным зарядом мы понимаем наименьший электрический заряд, равный по модулю заряду электрона.
Сразу обращаем ваше внимание на то, что зарядовое и массовое числа всегда целые и положительные. Помимо этого, они не имеют единиц измерения, поскольку указывают, во сколько раз масса и заряд ядра больше единичных.
Давайте ещё раз посмотрим на уравнение реакции альфа распада ядра атома радия. Легко заметить, что в процессе радиоактивного распада выполняются законы сохранения массового числа и заряда: массовое число и заряд распадающегося ядра атома равны соответственно сумме массовых чисел и сумме зарядов ядер атомов, образовавшихся в результате этого распада.
Из открытия, сделанного Резерфордом и Содди стало ясно, что радиоактивность — это не просто способность некоторых веществ к самопроизвольному излучению, но и способность к самопроизвольному превращению ядер одних химических элементов в ядра других химических элементов.
В физике принято выделять два вида радиоактивного распада — это α- и β-распад. Давайте рассмотрим некоторые их свойства.
Итак, мы уже знаем, что α-распад характеризуется вылетом ядра атома гелия. Следовательно, продуктом распада материнского ядра оказывается элемент, зарядовое число которого на 2 единицы меньше, а массовое число на 4 единицы меньше, чем у материнского ядра. Из особенностей α-распада выделим следующие:
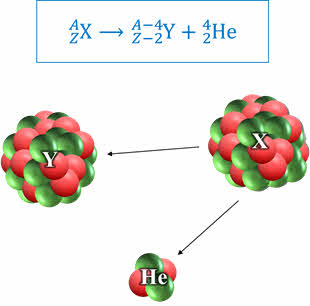
Во-первых, он наблюдается для природных ядер, зарядовое число которых больше 83 (это, так называемые, тяжёлые ядра, поскольку их атомная масса больше 200 а.е.м.).
А во-вторых, энергии и скорости испускаемых α-частиц в пучке очень близки друг к другу.
Как мы говорили на прошлом уроке, β-излучение является потоком электронов. Иными словами, при бета-распаде ядра самопроизвольно испускают электрон. В результате образуется новое ядро с тем же самым массовым числом, но с атомным номером на единицу больше.
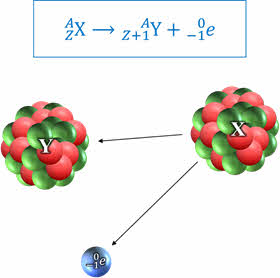
Из особенностей β-распада выделим то, что он наблюдается для тяжёлых и средних ядер, а скорости электронов сильно различаются по величине.
Интересно, что изучение β-распада показало, что в нём как бы нарушаются два фундаментальных закона: закон сохранения энергии и импульса. В связи с этим, швейцарский физик Вольфганг Эрнст Паули предположил, что при β-распаде рождается ещё какая-то частица, которая и уносит часть энергии и импульса. А итальянский физик Энрико Ферми показал, что эта частица нейтральная и имеет ничтожную массу. Он так же дал название этой частице — нейтрино.


Если вы внимательно следили за ходом решения задач, то могли заметить некоторую закономерность α- и β-распада:
При альфа-распаде ядро теряет положительный заряд «Два Е» и масса его убывает примерно на четыре атомных единицы массы. В результате элемент смещается на две клетки к началу периодической системы. После бета-распада элемент смещается на одну клетку ближе к концу периодической системы.
В 1913 году американцем Казимиром Фаянсом и англичанином Фредериком Содди эти закономерности были сведены в общее правило — правило смещения.
В заключении так же отметим, что в 1932 году французские учёные Фредерик и Ирен Жолио-Кюри, облучая нерадиоактивные вещества α-частицами, обнаружили, что некоторые из них после облучения становятся радиоактивными. Это явление получило название искусственной радиоактивности.
Таким образом, оказалось возможным получать радиоактивные изотопы веществ, которые обычно не радиоактивны.
Домашнее задание:
1. Сделать в рабочих тетрадях основные выводы из конспекта.
2. Решить задачи:
А) В какой элемент превратится Торий 23290Th, испытав два электронных β – распада и один α – распад?
Б) Из какого ядра после α – распада образовалось ядро изотопа полония 21684Po?