ПЛАН-КОНСПЕКТ (ТЕЗИСЫЛЕКЦИИ)
проведения занятия по дисциплине «Химия радиоматериалов»
Проводниковые материалы. Классификация
и основные свойства
(полное название темы в соответствии с тематическим планом)
Воронеж – 2011
ТЕМЫБЛОКА
| Вступительная часть ……………………………… 1. Электротехнические материалы 2. Классификация проводников. Основные свойства 3.Типовые материалы, применяемые в качестве проводников.…………………………….. |
Тема №1
ЭЛЕКТРОТЕХНИЧЕСКИЕ МАТЕРИАЛЫ, КЛАССИФИКАЦИЯ, ОСНОВНЫЕ СВОЙСТВА.
Материалы, широко используемые в радиоэлектронной аппаратуре, имеют различные названия: электротехнические материалы, радиотехнические материалы, материалы электронной техники. Однако принципиальной разницы между этими материалами нет. Несмотря на различия в названиях, все они применяются для изготовления деталей или компонентов и устройств электротехнической, радиотехнической, микроэлектронной, вычислительной аппаратуры. Тем не менее все материалы в интересующей нас области техники должны обладать вполне определенным набором свойств, благодаря которым они находят конкретное применение.
Объединяющим началом всех электротехнических материалов является набор их свойств по отношению к электромагнитному полю. При взаимодействии с электромагнитным полем проявляются электрические и магнитные свойства. Это позволяет дать определение понятия «электротехнические материалы» и классифицировать их.
Электро(радио)техническими материалами (ЭТМ) называются материалы, характеризующиеся определенными свойствами по отношению к электромагнитному полю и применяющиеся в технике с учетом этих свойств.
По основному электрическому свойству веществ—электропроводности— электротехнические материалы делятся на три группы: проводники, полупроводники и диэлектрики.
По магнитным свойствам вещества делятся на пять групп: диамагнетики, парамагнетики, ферромагнетики, антиферромагнетики и ферримагнетики.
Каждая из названных групп в свою очередь подразделяется на подгруппы по количественным параметрам, характеризующим их основные свойства. Это позволяет представить классификацию радиоматериалов в виде обобщенной схемы (рис. 1.1).
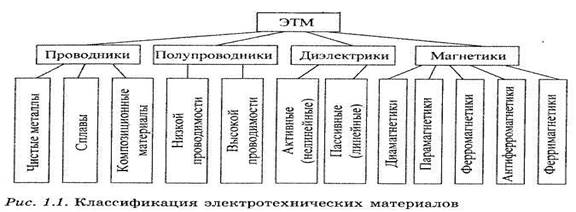
Для практического использования необходимо, чтобы в количественном отношении электрические или магнитные свойства были достаточно выражены, а механические, технологические и другие характеристики отвечали определенным требованиям. Поэтому не все из перечисленных групп одинаково широко используются в технике.
1.2. ФИЗИКО-ХИМИЧЕСКАЯ ПРИРОДА МАТЕРИАЛОВ
Все существующие в природе материалы независимо от их агрегатного состояния (газообразные, жидкие, твердые) построены из атомов более чем 100 химических элементов. Любое вещество (материал) состоит из огромного количества электрически заряженных частиц — электронов и атомных ядер химических элементов, которые и определяют его свойства.
Существуют способы упрощенного анализа свойств материалов, позволяющие использовать часть макроскопических характеристик, полученных экспериментально. При этом наиболее существенные особенности взаимодействия между электронами и ядрами химических элементов, образующих вещество, учитываются интегрально или автоматически.
Одним из таких способов является анализ химических связей элементов вещества. Естественно, что различия типов веществ обусловлены различием в характере распределения электронов в атомах и молекулах, и особенно в характере распределения наиболее удаленных от ядра валентных электронов и ионных атомных остовов. Сопоставляя между собой расположение атомов в структуре вещества, электронную конфигурацию этих атомов, тип химической связи между ними, можно ответить на ряд важных вопросов о макроскопических свойствах материала, таких, как электропроводность, способность к намагничиванию, плотность, твердость, пластичность, температура плавления и т.д.
Наиболее важным в данном подходе к анализу свойств материалов является вопрос о силах связи, удерживающих атомы вместе. Эти силы почти полностью являются силами электростатического взаимодействия между электронами и ядрами атомов. Роль сил магнитного происхождения весьма незначительна, а гравитационными силами, из-за малых значений масс взаимодействующих частиц, можно пренебречь. Существование стабильных связей между атомами вещества предполагает, что полная энергия ЕVп частиц в объеме V вещества в виде суммы кинетической Ек и потенциальной Un ЕV п = N (ЕVk+ UVn) меньше суммарной энергии этого же количества частиц вне объема, т.е. в свободном состоянии Есп= N (Еск + Ucn). Разность этих энергий Есп – ЕVп = Есв называется энергией химической связи, или энергией связи.
Экспериментально установлено, что электрофизические и механические свойства вещества или материала определяются характером связи и количественным значением энергии связи Есв.
По характеру взаимодействия между частицами, составляющими вещество, различают шесть типов химической связи:
• ковалентная неполярная;
• ковалентная полярная, или гомеополярная;
• ионная, или гетерополярная;
• донорно-акцепторная;
• металлическая;
• межмолекулярная.
Ковалентная неполярная связь возникает при объединении одноименных атомов в молекулы, например Н2, О2, Cl2, N2, алмаз, сера, Si, Ge и т.д. При этом происходит обобществление валентных электронов, что приводит к дополнению внешней электронной оболочки до устойчивого состояния. Молекулы с ковалентной неполярной связью имеют симметричное строение, т.е. центры положительного и отрицательного зарядов совпадают. В результате электрический момент молекулы равен нулю, т.е. молекула — неполярная, или нейтральная.
Следует напомнить, что электрический момент, отличный от нуля, характерен для дипольных молекул. Они представляют собой систему из двух одинаковых по величине и разноименных по знаку электрических зарядов q, расположенных на некотором расстоянии I друг от друга. Для такой системы зарядов или молекулы электрический или дипольный момент μ= ql.
Ковалентная неполярная связь характерна для диэлектриков и полупроводников.
Ковалентная полярная (гомеополярная, или парно-электронная) связь возникает при объединении разноименных атомов, например Н2О, СН4, СН3С1, СС14 и т.д. При этом также происходит обобществление пар валентных электронов и дополнение внешней оболочки до устойчивого состояния. Однако каждая связь имеет дипольный момент. Тем не менее молекула в целом может быть нейтральной или полярной (рис. 1.2).

Соединения с гомеополярной связью могут быть диэлектриками (полимерные органические материалы) и полупроводниками.
Ионная (гетерополярная) связь возникает при образовании молекулы элементами, находящимися в конце (VII группа) и начале (I группа) таблицы Д.И. Менделеева, например NaCl. При этом валентный электрон металла, слабо связанный с атомом, переходит к атому галогена, достраивая его орбиту до устойчивого состояния (8 электронов), В результате образуются два иона, между которыми действуют силы электростатического притяжения.
Ионные силы взаимодействия достаточно велики, поэтому вещества с ионной связью имеют сравнительно высокие механическую прочность, температуру плавления и испарения. Ионная связь характерна для диэлектриков.
Донорно-акцепторная связь по сути своей является разновидностью ионной связи и возникает при образовании материала элементами различных групп таблицы Д.И. Менделеева, например соединения AIII BV — GaAs и т.д.; соединения AIII BV - ZnS, CdTe и т.д. В таких соединениях атом одного элемента, называемый донором, отдает электрон другому атому, называемому акцептором. В результате возникает донорно-акцепторная химическая связь, являющаяся достаточно прочной. Материалы с такой связью могут быть диэлектриками и полупроводниками.
Металлическая связь возникает между атомами в металлах и является следствием обобществления всех валентных электронов, образующих электронный газ и компенсирующих заряд ионов кристаллической решетки. Благодаря взаимодействию электронного газа и ионов возникает металлическая связь. Обобществленные электроны слабо связаны с атомными остовами и, с энергетической точки зрения, являются свободными. Поэтому уже при очень слабых внешних электрических полях проявляется высокая электропроводность металлов.
Межмолекулярная, или остаточная, связь характерна для веществ органического происхождения, например парафина. Она возникает между молекулами вещества и является слабой, за счет чего такие материалы имеют низкие температуру плавления и механические характеристики, свидетельствующие о непрочности молекулярной структуры вещества.
Следует отметить, что обычно атомы в твердом теле не связаны каким-либо одним из рассмотренных видов связи. Поэтому свойства веществ и материалов на их основе удобнее рассматривать и оценивать, анализируя энергетический спектр электронов атомов, составляющих вещество.
Тема №2