В современной химии используется номенклатура, сформулированная в первой половине XX века комиссией International Union of Pure and Application Chemistry (IUPAC). С развитием науки, способы построения названий непрерывно развиваются. Систематическая номенклатура (или номенклатура IUPAC) позволяет наиболее полно и однозначно описать строение молекулы вещества или класса веществ, направление и результат химической реакции.
В основу IUPAC номенклатуры органических соединений входят следующие основные понятия, необходимые для правильного построения названий и структурных формул по названию веществ:
Главная (основная) цепь – наиболее протяженная цепочка атомов углерода содержащая максимальное количество заместителей (см.) Атомы главной цепи номеруются (порядок нумерации см. ниже). Название главной цепи состоит из греческого числительного указывающего на число атомов в ней и указанием наличия или отсутствия кратных связей (в окончании). Если главная цепь замкнута в цикл (несколько циклов), то в названии перед обозначением главной цепи добавляют приставку «цикло» (бицикло, трицикло и т.д. в зависимости от количества циклов образованных главной цепью).
Заместители – атом или группа атомов соединенные с главной цепью ковалентной связью. При составлении названия каждому заместителю присваивается номер, соответствующий нумерации атомов главной цепи. Номера в названии отделяются от остального слова черточками с двух сторон. При наличии в молекуле нескольких одинаковых заместителей, числительные, указывающие их положение приводятся через запятую, и к названию заместителя прибавляется приставка, указывающая на количество одинаковых групп (ди-, три-, тетра- и т.д.).
Следует особо отметить, что направление нумерации главной цепи выбирается таким образом, чтобы сумма номеров всех заместителей была наименьшей, и старший заместитель имел минимальный номер.
Старший заместитель – На основании таблицы 1 выбирается наиболее старший заместитель и его название вместе с соответствующим номером указывается в суффиксе (после названия главной цепи). Остальные заместители с их номерами указываются в приставке (до названия главной цепи) в алфавитном порядке в соответствии с алфавитом языка, на котором приведено название.
Скобки – Для упрощения восприятия сложных названий и описания составных заместителей используют однократные или многократные скобки. В правилах IUPAC нет четких указаний, и используют как многократные круглые скобки, так и сочетание круглых, квадратных и фигурных скобок.
Таблица 1 Заместители по возрастанию старшинства.
Обозначения в приставках и суффиксах.
| Заместитель | приставка | суффикс |
| СН3-; СН2СН3- и т.д. | метил-; этил- и т.д. | - |

| фенил- | -бензол |
| НСºС- | этинил- | обозначение присутствия тройной связи в главной цепи -ин |
| Н2С=СН- | этенил- | обозначение присутствия двойной связи в главной цепи -ен |
| NO2- | нитро- | - |
| NH2- | амино- | -амин |
| F-, Cl-, Br-, J- | хлор- (пример) | -хлорид (пример) |
| OH- (спирт, фенол) | окси- | -ол |
| SH- (тиол, тиофенол) | меркапто- | -тиол |
| -C=O (кетон) | оксо- | -он |
| -CHO (альдегид) | оксо- | -аль |
| -CºN (нитрил) | циано- | -нитрил |
| -COOH (карбоновая кислота) | карбокси- | -овая кислота |
Примеры:
Приведена нумерация основной цепи. Для наглядности числительное, указывающее длину главной цепи, подчеркнуто. Расположение названий заместителей в алфавитном порядке (русский алфавит). Заглавная буква (Е) указывает на пространственное строение двойной связи (см. главу 4 «изомерия»). Цифры в квадратных скобках [2.2.1] показывают протяженность (количество атомов) каждого из мостов каркасного (полициклического) соединения.
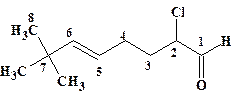 (Е)-7,7-диметил-2-хлор окт ен-5-аль-1
(Е)-7,7-диметил-2-хлор окт ен-5-аль-1
|  6-бром-5-(2-метилпропил)цикло гепт адиен-2,4-ол-1
6-бром-5-(2-метилпропил)цикло гепт адиен-2,4-ол-1
|
 5-аминонафталин-2-карбоновая
кислота*
5-аминонафталин-2-карбоновая
кислота*
| 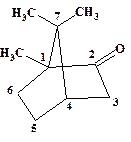 1,7,7-триметилбицикло[2.2.1] гепт ан-2-он
(Камфора**)
1,7,7-триметилбицикло[2.2.1] гепт ан-2-он
(Камфора**)
|
*Используется тривиальное название ядра – нафталин. **Тривиальное название
Подробную информацию о номенклатурных правилах IUPAC можно посмотреть в Интернете, например: www.acdlabs.com/iupac/nomenclature.
В приведенных примерах используется т.н. сокращенная запись структурных формул органических молекул, она позволяет в компактной и понятной форме изобразить схему пространственной структуры молекулы. В этой записи линиями указываются ковалентные связи, не указываются атомы углерода и водорода в цепи кроме концевых атомов (в некоторых случаях опускают и их, вместо метильной группы рисуют заметную точку на конце линии). Кратности связи указывается удвоением (или утроением) линий. Подразумевается, что в каждом узле (изгибе или разветвлении) линии содержится атом углерода с необходимым, с точки зрения валентности, числом атомов водорода. Атомы любых других элементов (т.н. гетероатомы) указываются обязательно. Для удобства восприятия, здесь и далее структурные формулы органических веществ будут приводиться в сокращенной форме.
Следует отметить, что наряду с систематической, используют тривиальную номенклатуру. До настоящего времени для некоторых классов органических соединений, таких как карбоновые кислоты, амины, ароматические и многие природные соединения тривиальные названия используют также широко, как и систематические. Тривиальные названия веществ, как правило, не связаны напрямую со строением. Иногда они обозначают источник получения данного вещества (муравьиная, уксусная, валериановая, щавелевая кислоты, нафталин, геранеол, цитраль, мочевина), иногда некоторые свойства или способ получения (серный эфир, анилиновые красители). Тривиальные названия многих соединений и фрагментов используют до настоящего времени для упрощения и сокращения названий (см. примеры).

 Особенно в последнее время широко используются сокращения и аббревиатуры. Например: ДМСО (диметилсульфоксид) – распространенный полярный апротонный растворитель, ДДТ (1,1,1-трихлор-2,2-бис-(4-хлорфенил)этан) – инсектицид, АТФ (аденозинтрифосфорная кислота) и др. Часто аббревиатуры используют для обозначения активно используемых реагентов и катализаторов. например ДЦК (N,N`-дициклогексилкарбодиимид), ТМЕДА (N,N,N`,N`-тетраметилэтилендиамин-1,2).
Особенно в последнее время широко используются сокращения и аббревиатуры. Например: ДМСО (диметилсульфоксид) – распространенный полярный апротонный растворитель, ДДТ (1,1,1-трихлор-2,2-бис-(4-хлорфенил)этан) – инсектицид, АТФ (аденозинтрифосфорная кислота) и др. Часто аббревиатуры используют для обозначения активно используемых реагентов и катализаторов. например ДЦК (N,N`-дициклогексилкарбодиимид), ТМЕДА (N,N,N`,N`-тетраметилэтилендиамин-1,2).
В дальнейшем, разбирая классы органических соединений и их реакционную способность, мы еще много раз вернемся и к систематической, и к тривиальной номенклатуре на конкретных примерах.
В связи со стремительным развитием вычислительной техники, сложности с составлением правильного называния конкретной молекулы или изображение структурной формулы по заданному систематическому названию отошли в прошлое. Существует целый ряд специализированных компьютерных программ, позволяющих корректно решать такие задачи. Однако следует иметь в виду, что большинство известных программ генерируют латинские названия органических соединений, и перечисление заместителей организуется в соответствии с латинским алфавитом. При переводе на русский язык порядок часто меняется.
Глава 3. Типы реакций в органической химии:
 Химическая связь с позиции теории молекулярных орбиталей – явление перераспределения электронной плотности валентных электронов. Из отдельных атомных орбиталей образуются молекулярные орбитали, общие для атомов образующих связь и имеющие другую геометрию. На схеме приведен простейший пример энергетической диаграммы образования двух молекулярных орбиталей для соединения А-В – связывающей (заселенная) и разрыхляющей (свободная). Электроотрицателность (сродство к электрону) элемента А выше чем В. Энергия атомной орбитали атома А ниже чем В, ВЗМО (высшая занятая молекулярная орбиталь) ближе по энергии к атомной орбитали атома А, а НСМО (низшая свободная молекулярная орбиталь) подобна атомной В. Следовательно, в данном примере, электронная плотность общего электронного облака молекулярной орбитали смещена к атому А, и связь поляризована (наблюдается дипольный момент).
Химическая связь с позиции теории молекулярных орбиталей – явление перераспределения электронной плотности валентных электронов. Из отдельных атомных орбиталей образуются молекулярные орбитали, общие для атомов образующих связь и имеющие другую геометрию. На схеме приведен простейший пример энергетической диаграммы образования двух молекулярных орбиталей для соединения А-В – связывающей (заселенная) и разрыхляющей (свободная). Электроотрицателность (сродство к электрону) элемента А выше чем В. Энергия атомной орбитали атома А ниже чем В, ВЗМО (высшая занятая молекулярная орбиталь) ближе по энергии к атомной орбитали атома А, а НСМО (низшая свободная молекулярная орбиталь) подобна атомной В. Следовательно, в данном примере, электронная плотность общего электронного облака молекулярной орбитали смещена к атому А, и связь поляризована (наблюдается дипольный момент).
Подразделяют ковалентную связь, когда образуется общая для обоих атомов электронная пара. В терминах молекулярных орбиталей можно сказать, что ковалентная связь образуется при взаимодействии электронов, энергии атомных орбиталей которых сопоставимы и образуется заселенная молекулярная орбиталь. Ковалентная связь между атомами с равной электроотрицательностью называется неполярной (энергии атомных орбиталей, участвующих в образовании связи, равны, и дипольный момент нулевой). Связь между атомами с разной электроотрицательностью (пример см. выше) называют полярной, так как за счет смещения электронной плотности к атому, имеющему большее сродство к электрону, образуется диполь.
Ионная связь – предельный случай полярной ковалентной связи, разница в энергиях атомных орбиталей значительна и образующаяся ВЗМО очень далека по энергии от атомной орбитали элемента с меньшей электроотрицательностью. Электронная пара, образующаяся в процессе взаимодействия, практически полностью переносится к одному из атомов участвующих во взаимодействии с образованием заряженных частиц (ионной пары). Однако, последние исследования показали, что данный тип связи в пределе не реализуется даже в общепринято «ионных соединениях», где разница в электроотрицательности атомов максимально велика. Таким образом, степень «ионности» химической связи всегда меньше 100%. Например, для H+Cl– (15% «ионности»), Na+Cl– (85%). То есть можно говорить об «очень» полярной ковалентной связи.
Степень ионности связи относится только к кристаллической форме вещества. В водном растворе (полярный растворитель), за счет выигрыша в энергии при сольватации отдельных ионов молекулами растворителя связь становится ионной на 100%. Так, в водном растворе HCl нет молекул H-Cl, а наблюдаются только гидратированные ионы H+ и Cl–. В противовес этому факту, в неполярных органических растворителях (например в углеводородах) хлористый водород присутствует в виде нейтральных молекул.
Отдельно следует отметить металлическую связь – взаимодействие многих атомов с обобществлением всех валентных электронов и образованием единой «макромолекулы» и молекулярных орбиталей «слоев». Одним из признаков присутствия металлической связи является высокая тепло- и электропроводность за счет наличия единого электронного «слоя».
Другие типы связей – водородная, семиполярная, донорно-акцапторная и.т.п. будут рассмотрены позже в приложении соответствующих реакций и классов соединений.
В курсе органической химии мы будем иметь дело в основном с ковалентными связями.
Таблица 2. Энергии некоторых простых ковалентных связей (ккал/моль)
| H | C | N | O | F | Cl | Br | I | |
| H | ||||||||
| C | ||||||||
| N | ||||||||
| O |
Таблица 3. Энергии некоторых кратных ковалентных связей (ккал/моль)
| C=C | C≡C | C=N | C≡N | C=O | N=N | N≡N |
Помимо образования, многие химические реакции сопровождаются разрывом ковалентных связей.
Пути разрыва ковалентных связей:
 Гомолитический разрыв – образование нейтральных радикалов (частиц с неспаренными электронами). Чаще всего гомолитический разрыв связи реализуется в случае неполярной или малополярной ковалентной связи. Кроме того, гомолитический разрыв ковалентной связи наблюдается при инициации сторонним реагентом несущим неспаренный электрон (радикалом). В последнем случае полярность исходной связи не имеет значения.
Гомолитический разрыв – образование нейтральных радикалов (частиц с неспаренными электронами). Чаще всего гомолитический разрыв связи реализуется в случае неполярной или малополярной ковалентной связи. Кроме того, гомолитический разрыв ковалентной связи наблюдается при инициации сторонним реагентом несущим неспаренный электрон (радикалом). В последнем случае полярность исходной связи не имеет значения.
 Гетеролитический разрыв – образование пары заряженных ионов. Реализуется, как правило, в случае полярной ковалентной или ионной связи. Естественно, что в виде катиона уходит частица обладающая меньшей электроотрицательностью.
Гетеролитический разрыв – образование пары заряженных ионов. Реализуется, как правило, в случае полярной ковалентной или ионной связи. Естественно, что в виде катиона уходит частица обладающая меньшей электроотрицательностью.
Типы химических реакций:
1. Ad (addition)  присоединение. Реакция, сопровождающаяся разрывом кратной связи и образованием двух простых ковалентных связей. В органической химии реализуются реакции присоединения по связям С=С, С≡С, С=О, С=N, C≡N и т.п.
присоединение. Реакция, сопровождающаяся разрывом кратной связи и образованием двух простых ковалентных связей. В органической химии реализуются реакции присоединения по связям С=С, С≡С, С=О, С=N, C≡N и т.п.
2. 
 S (substitution) замещение. Реакция, результатом которой является замещение одного атома (группы атомов) на другой атом или группу атомов. Подразделяют нуклеофильное замещение (SN) где и уходящая группа и атакующая частица несут избыток электронной плотности – нуклеофилы «любящие ядра», и электрофильное замещение (SE) где уходящая группа и атакующая частица имеют недостаток электронной плотности – электрофилы «любящие электроны».
S (substitution) замещение. Реакция, результатом которой является замещение одного атома (группы атомов) на другой атом или группу атомов. Подразделяют нуклеофильное замещение (SN) где и уходящая группа и атакующая частица несут избыток электронной плотности – нуклеофилы «любящие ядра», и электрофильное замещение (SE) где уходящая группа и атакующая частица имеют недостаток электронной плотности – электрофилы «любящие электроны».
3. E (elimination) элиминирование. Реакция противоположная по направленности реакции присоединения. Один из основных способов образования кратных  связей в органических молекулах. Кроме вышеозначенной реакции β-элиминирования, где отщепление происходит от соседних атомов, существуют реакции γ-, δ- и др. элиминирования. В
связей в органических молекулах. Кроме вышеозначенной реакции β-элиминирования, где отщепление происходит от соседних атомов, существуют реакции γ-, δ- и др. элиминирования. В  этих случаях не образуется кратной связи, а возникает циклический фрагмент.
этих случаях не образуется кратной связи, а возникает циклический фрагмент.
4.  перегруппировка. Реакция, в которой меняется структура углеродного скелета молекулы или заместителей без изменения брутто-формулы. Например, термическая перегруппировка азулена в нафталин. Иногда, перегруппировками называют реакции, в которых состав продукта отличен от исходного, но изменение углеродного скелета и порядка связей также присутствует.
перегруппировка. Реакция, в которой меняется структура углеродного скелета молекулы или заместителей без изменения брутто-формулы. Например, термическая перегруппировка азулена в нафталин. Иногда, перегруппировками называют реакции, в которых состав продукта отличен от исходного, но изменение углеродного скелета и порядка связей также присутствует.
Образование преимущественно одного из нескольких возможных продуктов реакции называется селективность. Если образуется только один из нескольких продуктов, говорят о специфичности реакции.
Глава 4. Изомерия.
Изомеры – химические соединения, имеющие одинаковый количественный состав молекулы (имеют одинаковую брутто-формулу).
По возрастанию схожести молекул подразделяют следующие типы изомерии:
1. Изомерия классов соединений. Физические (температуры кипения и плавления, теплоемкость, плотность и т.п.) и химические свойства сильно различаются.
Пример: С4Н10О бутанол (спирт) и диэтиловый эфир (простой эфир).
Образование в процессе реакции соединений преимущественно одного класса из двух или нескольких возможных называется хемиоселективность.
2. Изомерия положения заместителей (частный случай – изомерия углеродного скелета). Физические свойства различны, многие химические свойства близки, но, как правило, существуют различия в реакционной способности и скоростях протекания реакций с участием соответствующих изомеров.
Пример: С4Н10О н-бутиловый, изо-бутиловый, втор-бутиловый и трет-бутиловый спирты; С7Н7Cl о-, м- и п-хлортолуолы; С4Н10О Диэтиловый и метилпропиловый эфиры.
Образование в процессе реакции преимущественно одного изомера положения из нескольких возможных называется региоселективность. Образование исключительно одного изомера называется региоспецифичность.
3. Пространственная изомерия
 3а изомерия положения заместителей при двойной связи – цис/транс или Z/E изомерия. Физические свойства немного различаются, химические свойства отличаются не значительно.
3а изомерия положения заместителей при двойной связи – цис/транс или Z/E изомерия. Физические свойства немного различаются, химические свойства отличаются не значительно.
Пример: (E)- и (Z)-2-бром-3-хлорбутены-2.
Принадлежность к Z или E ряду определяется старшинством пар заместителей у атомов углерода образующих кратную связь. Старшинство заместителей принято определять по системе, разработанной Канном, Ингольдом, Прелогом (КИП). Если более «тяжелые» заместители расположены по одну сторону от оси двойной связи, то этот изомер называют Z, а по разные стороны – E.
Правила определения старшинства заместителей КИП.
1. рассматривают атомы связанные непосредственно связанные с рассматриваемым атомом. Старшим считается атом с наибольшим порядковым номером, и далее старшинство убывает в порядке уменьшения атомных номеров.
2. Если атомы, непосредственно связанные с центром асимметрии, имеют одинаковый атомный номер, то рассматривают атомные номера атомов следующих по связям (через две связи от рассматриваемого центра, потом через три связи и т. д.). Сравнение проводят до появления первого отличия. Отличием также считается разное количество самых тяжелых атомов связанных с рассматриваемыми.

3. Атомы, образующие кратные связи, рассматривают (формально) как увеличенное в n-раз (n – кратность связи) число этих атомов присоединенных одинарными связями «фантомные атомы» (на схеме обведены).

4. При сравнении изотопов одного элемента, приоритетом обладает более тяжелый изотоп.
Наличие изомеров обусловлено высоким энергетическим барьером вращения вокруг кратной связи. Термически возможно осуществить переход от менее термодинамически выгодного цис-изомера, к более устойчивому – транс-изомеру.
Следует особо отметить, что термины цис- и танс- можно использовать только в случае присутствия двух отличных от водорода заместителей при двойной связи (по одному у каждого углеродного атома). Во всех остальных случаях приемлемо только использование терминологии Z/E изомерии.
3б Оптическая изомерия (хиральность). В общем случае, оптические изомеры являются зеркальным отражением друг друга, но не способны совместится с помощью операций симметрии (кроме зеркального поворота). Возможна точечная хиральность (в молекуле содержится один или несколько атомов углерода содержащих четыре разных заместителя), осевая или линейная хиральность (левая и правая спираль с разными концами). Физические свойства одинаковы, кроме способности вращать плоскость плоско-поляризованного света при прохождении последнего через раствор или кристалл соответствующего изомера. Один изомер (энантиомер) вращает плоскость по часовой стрелке, а другой против часовой стрелки, на тот же угол. Это свойство присуще только хиральным соединениям и связано с разницей во взаимодействии хиральной молекулы с двумя циркулярными составляющими плоско-поляризованного света. Это свойство легло в основу одного из названий этого типа изомерии – оптическая. Химические свойства энантиомеров одинаковы, кроме случаев взаимодействия с хиральными же молекулами.
На этом последнем свойстве основаны методы разделения рацемических смесей энантиомеров (смесь оптических изомеров в соотношении 1:1.) Рацемические смеси, как правило, оптически не деятельны. При взаимодействии рацемической смеси с одним хиральным изомером реагента образуются продукты, проявляющие разные физико-химические свойства. Их разделяют, пользуясь этой разницей, а затем регенерируют исходные вещества. Это же свойство используют при проведении стереоселективных превращений органических соединений. Либо используют заведомо чистый оптически-активный субстрат и применяют реакции, позволяющие сохранить или обратить его конфигурацию, либо при использовании рацемических или ахиральных субстратов используют хиральные катализаторы, добавки (содействующие вещества) или растворители.
Пример: R- и S-1-бром-1-фтор-1-хлорэтаны

 По правилам номенклатуры IUPAC абсолютные конфигурации точечного оптического (хирального) центра определяют по направлению убывания старшинства заместителей, при этом самый младший заместитель направлен от наблюдателя. Если убывание по часовой стрелке – то R, если против – то S. Правила старшинства заместителей идентичны используемым в определении Z/E изомеров (правило КИП).
По правилам номенклатуры IUPAC абсолютные конфигурации точечного оптического (хирального) центра определяют по направлению убывания старшинства заместителей, при этом самый младший заместитель направлен от наблюдателя. Если убывание по часовой стрелке – то R, если против – то S. Правила старшинства заместителей идентичны используемым в определении Z/E изомеров (правило КИП).
Большинство органических молекул встречающихся в биологических объектах имеют один или несколько оптических (хиральных) центров. Причем, как правило, в природе встречается исключительно один из двух или нескольких изомеров.
Реакции, протекающие с преимущественным образованием одного из пространственных изомеров, называются стереоселективными. В приложении к оптической изомерии (хиральности) часто используют термин энантиоселективность. При образовании исключительно одного изомера используют термины стереоспецифичность и энантиоспецифичность.
Исторически, для описания строения некоторых природных хиральных молекул была введена т.н. относительная конфигурация (D/L номенклатура), а для упрощения изображения пространственных изомеров на плоскости - проекции Фишера. За основу был взят глицериновый альдегид (самый простой сахарид).
На схеме представлен переход от клиновидной проекции D-глицеринового альдегида – (R) конфигурация к проекции Фишера. (В клиновидной проекции связи расположенные в плоскости чертежа изображают тонкими линиями, связи направленные в сторону наблюдателя жирными линиями или закрашенным клином к заместителю, а связи направленные от наблюдателя пунктирными линиями или пунктирным клином)

Для L-глицеринового альдегида в проекции Фишера гидроксильная группа будет располагаться слева.

Таким образом, если при написании проекции Фишера для некоторого хирального соединения, конфигурация его оптического центра будет аналогичной L-глицериновому альдегиду, то это соединение относят к L-ряду и наоборот.
За редким исключением в природных объектах присутствуют D-сахара и их производные и L-аминокислоты в свободном виде и в составе белковых молекул во всем их разнообразии. В сахарах имеющих в подавляющем большинстве случаев несколько хиральных центров, принадлежности к D- или L-ряду определяют по конфигурации самого дальнего от карбонильной группы центра.
Направленный синтез органических соединений с заданной конфигурацией хиральных центров – стереоселективный синтез – одна из важнейших, и вместе с тем наиболее сложных задач современной органической химии. Следует особо отметить, что в отличие от лабораторной и промышленной практики, в биологических объектах эта проблема решена полностью. Все биохимические процессы в живом организме, протекающие с участием хиральных молекул, стереоспецифичны. В последнее время этой способностью стали пользоваться и в синтетической практике, используя в качестве хиральных реагентов или катализаторов отдельные ферменты и их смеси или целые живые клетки (бактерии, одноклеточные грибы).