Вариант №8
Задание №15. Чем отличаются растворы высокомолекулярных веществ (ВМВ) от дисперсных систем? Какие процессы называют набуханием ВМВ, а какие – застудневанием?
Ответ
Растворы ВМС имеют ряд специфических особенностей. В отличие от коллоидных систем растворы высокомолекулярных веществ образуются самопроизвольно при контакте полимера с растворителем путем набухания, переходящего в растворение. Самопроизвольный процесс растворения сопровождается уменьшением энергии Гельмгольца в системе (ΔА < 0), тогда как диспергирование вещества до коллоидного состояния требует значительных затрат энергии (ΔА > 0). Коллоидные растворы, обладающие избыточной поверхностной энергией, термически неустойчивы, не могут быть получены и не могут существовать без присутствия стабилизатора и даже при его наличии способны стареть.
Растворы высокомолекулярных соединений при неизменности внешних условий могут существовать неограниченно долго без стабилизирующих добавок и являются термодинамически устойчивыми. Вследствие этого процессы, происходящие в них с изменением температуры, давления и концентрации, обратимы. Обратимость свойств и подчинение растворов ВМС правилу фаз также подтверждают их термодинамическую устойчивость. Однако следует отметить, что равновесие в растворах ВМС устанавливается чрезвычайно медленно (иногда через недели и месяцы и более).
Высокомолекулярные соединения, как и низкомолекулярные вещества в зависимости от условий могут образовывать не только истинные, но и коллоидные растворы (например, латексы - это коллоидные растворы каучуков в водной среде). Нередко растворы ВМС проявляют свойства коллоидов лишь частично. Гибкие макромолекулы способны при тепловом движении изменять форму в растворе. Такие различные формы макромолекул, переходящие друг в друга, называют конформациями. В хороших растворителях макромолекулы обычно вытянуты и гибки, в плохих более жестки, проявляют тенденцию к свертыванию.
Растворы, в которых макромолекулы свернуты в клубок, в большей степени проявляют свойства коллоидных растворов, так как макромолекулы, свернутые в клубок, можно рассматривать как зародыши новой фазы, поскольку наружные и внутренние части клубка находятся в разных условиях. Как зародыши новой фазы можно рассматривать ассоциаты молекул, тенденция к образованию которых наблюдается в растворах средних концентраций. Такие растворы высокомолекулярных соединений сближаются по свойствам с коллоидными.
Набухание ВМС. При контакте полимера с растворителем всегда происходит его набухание. Набухание – это самопроизвольный процесс поглощения низкомолекулярного растворителя высокомолекулярным веществом, сопровождающийся увеличением его массы и объема до 1000 - 1500 %. Набухание является начальным этапом растворения ВМС. Различают ограниченное и неограниченное набухание.
При ограниченном набухании объем и масса полимера достигают определенных значений и дальнейший контакт полимера с растворителем не приносит каких-либо изменений. Ограниченно набухший полимер называется студнем. Неограниченное набухание характеризуется отсутствием предела набухания, со временем полимер поглощает все большее количество жидкости и в результате набухание переходит в растворение. Примером ограниченного набухания является набухание резины в бензоле; набухание же каучука в этом растворителе неограниченно.
На характер набухания влияет температура. Так, желатин и агар-агар в холодной воде набухают до определенного предела, т. е. ограниченно, при нагревании же они набухают неограниченно и растворяются.
Причиной набухания является диффузия низкомолекулярного растворителя в высокомолекулярное вещество. Набухание можно представить, как одностороннее смешивание, при котором молекулы низкомолекулярного вещества благодаря большой подвижности проникают в пространство между молекулами полимера. В большинстве случаев набухание включает не только простую диффузию молекул жидкости в полимер, но и сольватацию макромолекул. Если растворитель полярен, то сольватируются полярные группы макромолекул, если неполярен, то сольватируются неполярные группы. В зависимости от того, каких групп в полимере больше, он будет набухать в полярном или неполярном растворителе.
Процесс набухания можно разбить на две стадии. На первой стадии низкомолекулярный растворитель, диффундируя в высокомолекулярное вещество, сольватирует его макромолекулы. Процесс сопровождается выделением тепла. Молекулы растворителя в сольватной оболочке отличаются плотной упаковкой и растворитель в сольватной оболочке имеет более высокую плотность. На первой стадии набухания наряду с увеличением объема полимера наблюдается суммарное уменьшение объема всей системы.
На второй стадии набухания, идущей без теплового эффекта, наблюдается основное увеличение объема полимера. Молекулы жидкости диффундируют в полимер, и происходит смешивание больших и гибких макромолекул с молекулами растворителя.
Застудневание (желатинирование) – процесс фазового перехода из жидкого состояния в твёрдое состояние. Образование студня происходит в результате взаимодействия между макромолекулами ВМС. Макромолекулы неоднородны и имеют лиофильные (по отношению к воде – гидрофильные) и лиофобные (гидрофобные) участки. У гидрофильных групп макромолекул (-NH2, -COH, =NH, -OН, -COOH) образуются гидратные слои. Эти слои экранируют отдельные участки макромолекул. Гидрофобные группы (например, -СН2– боковых звеньев белков) неспособны формировать подобные слои. Наличие свободных, не защищённых сольватной (гидратной) оболочкой участков макромолекул при определённых условиях, в частности при росте концентрации ВМС, приводит к возникновению взаимодействия между этими участками; в результате образуется структура (каркас, сетка) из макромолекул ВМС, а раствор ВМС переходит в студень. Причины возникновения прочных связей могут быть разными. Например, если полимер содержит ионогенные группы, то взаимодействие этих групп, несущих противоположные по знаку заряды, является одной из причин образования межмолекулярных связей. Полярные группы макромолекул также могут взаимодействовать друг с другом. Иногда возможно образование и водородных связей.
Застудневание (или желатинирование) может происходить самопроизвольно под действием электролитов и при изменении температуры. Так, например, 30 – 34%-й раствор желатина застудневает при 303 К, а 10% -й раствор при более низкой температуре, равной 295К. Повышение концентрации ВМС всегда увеличивает вероятность застудневания, так как при этом возрастает вероятность столкновения макромолекул или их фрагментов. При этом возрастает вероятность образования межмолекулярных связей и, следовательно, появления в системе каркаса. Обычно такой эффект вызывает и понижение температуры, хотя бывают и исключения. Исключения объясняются отрицательным температурным коэффициентом растворимости ВМС.
Застудневанию растворов ВМС всегда способствует повышение концентрации, так как при этом возрастает частота столкновений между макромолекулами или их участками и увеличивается число связей, образующихся в единице объёма студня. Однако, если молекулы полимера вытянуты, то застудневание может проходить и в очень разбавленных растворах. Так, при обычной температуре раствор агара образует студень при его содержании в нём 0,2% сухого вещества.
Задание №19. C позиции теории ДЛФО, ответьте, какую электролитную коагуляцию называют нейтрализационной, а какую – концентрационной? Какие электролиты являются индифферентными а какие –неиндифферентными?
Ответ
В случае, если в результате введения электролита происходит адсорбция ионов на поверхности частиц и снижается потенциал поверхности до некоторой критической величины, после достижения которой начинается процесс нарушения агрегативной устойчивости, говорят о нейтрализационной коагуляции. Адсорбционной способностью обладают ионы, способные достраивать кристаллическую решетку частиц, или поливалентные ионы, обладающие специфическим адсорбционным потенциалом.
Концентрационная коагуляция - процесс необратимого нарушения агрегативной устойчивости - происходит при введении электролитов вплоть до критической концентрации, называемой порогом коагуляции, когда вследствие сжатия диффузных оболочек двойного электрического слоя частиц до некоторой критической толщины энергия отталкивания частиц уравняется с энергией притяжения. После этого любое столкновение частиц приводит к их слипанию, а формирование больших агрегатов первичных частиц приводит к выпадению дисперсной фазы в осадок, т.е. нарушается и кинетическая устойчивость.
Индифферентный (безразличный) электролит – электролит, не содержащий ионов, способных достраивать кристаллическую решетку агрегата. Например, возьмем агрегат [As2S3]m. Для него индифферентными будут являться следующие соли - NaNO3, KMnO4, CaCl2. Ни один из электролитов не содержит ни ионов As3+, ни ионов S2–.
Неиндифферентный (небезразличный) электролит – электролит, содержащий ионы, способные достраивать кристаллическую решетку агрегата. Например, агрегат золя – [AgJ]m. Неиндифферентными электролитами будут все электролиты, содержащие ионы J–, либо ионы Ag+. Такими солями могут быть – это KJ и AgNO3.
Задание №39. Коллоидный раствор (золь) АД получен при смешивании V1мл водного раствора АС с молярной концентрацией эквивалентов С1 и V2 мл водного раствора ВД с молярной концентрацией эквивалентов С2.
1. Напишите уравнение реакции получения вещества, образующего золь АД.
2. Рассчитайте, какое из исходных веществ АС или ВД в избытке. Определите ионный состав раствора и выберите, какой из ионов будет потенциалопределяющим (ПОИ).
3. Напишите формулу мицеллы в гидрозоле АД и назовите все ее составные части.
4. Укажите заряд коллоидной частицы (гранулы) и определите, какой ион (катион или анион) будет ионом-коагулятором.
5. Расположите электролиты К2SO4, Nа3PO4, MgСl2, Сd(NO3)2, Аl2(SO4)3 в порядке увеличения коагулирующей способности иона-коагулятора (или уменьшение порога коагуляции золя).
| Вариант | АД | АС | V1, мл | С1,моль\л | ВД | V2, мл | С2,моль\л |
| Cг(ОН)3 | СгСI3 | 0,01 | NН4OH | 0,02 |
Ответ
1. Уравнение реакции получения вещества, образующего золь Cг(ОН)3:
СгСI3 + 3 NН4OH = Cг(ОН)3 ↓ + 3 NН4СI
гидрозоль образует Cг(ОН)3↓, т. к. плохо растворяется в воде.
2. Рассчитываем, какое из исходных веществ взято в избытке, для этого находимчисло моль эквивалентов каждого из исходных веществ:
nэк(В) = V × Cм× Z,
где V – объем раствора, л;
См – молярная концентрация, моль/л;
Z – число эквивалентности вещества.
nэк(СгСI3) = 10×10 –3×0,01×3 = 3×10 –4 моль
Z(СгСI3) = 3
nэк(NН4OH) = 16 × 10 –3× 0,02 × 1 = 3,2 ×10–4 моль
Z(NН4OH) = 1
В избытке взят CrCI3.
Потенциалопределяющими ионами (ПОИ) являются ионы Cr3+, т. к. они взятыв избытке.
3. Формула мицеллы золя гидроксида хрома (III):
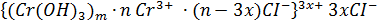 - мицелла
- мицелла
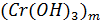 – ядро мицеллы;
– ядро мицеллы;
 - агрегат, при этом
- агрегат, при этом  - потенциалопределяющие ионы;
- потенциалопределяющие ионы;
 - гранула
- гранула
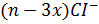 - противоионы
- противоионы
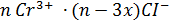 - двойной электрический слой
- двойной электрический слой
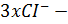 диффузный слой
диффузный слой
4. Заряд коллоидной частицы – положительный.
Ион-коагулятор – отрицательно заряженный ион или анион.
5. Электролиты в порядке увеличения коагулирующей способности иона-коагулятора:
1) MgСl2, Сd(NO3)2 – наименьшая коагулирующая способность
2) К2SO4, Аl2(SO4)3
3) Nа3PO4– наибольшая коагулирующая способность
Задание №59. Определите радиус частиц суспензии коалина в воде, если среднеквадратичный сдвиг -D равен 12 мкм за время 120 с. Температура опыта 293 К, вязкость среды 1,1×10-3 Па×с.
Решение
По закону Эйнштейна среднеквадратичный сдвиг равен:
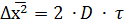
где 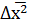 – среднеквадратичный сдвиг, мкм;
– среднеквадратичный сдвиг, мкм;
D – коэффициент диффузии;
τ – время, сек.
Откуда D = 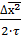
С другой стороны, для сферических частиц радиусом r коэффициент диффузии равен:
D= 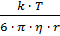
Где k – постоянная Больцмана, k = 1.38 × 10-23 Дж/К;
r – радиус частицы, нм;
η – вязкость среды, Па · с.
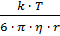 =
= 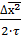
Выразим радиус сферической частицы:
r = 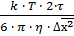 =
= 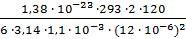 = 32,52 · 10-8 м = 325,2· 10-9 м
= 32,52 · 10-8 м = 325,2· 10-9 м
или r = 325,2 нм
Ответ. r =325,2 нм.
Задание № 79. Сточные воды производства фотоматериалов содержат коллоидное серебро в виде иодида серебра. Рассчитайте расход Al2(SO4)3 (кг) на очистку 1000 м3 сточных вод, предполагая, что знак электрических зарядов коллоидных частиц положительный. Пороги коагуляции (в моль/м3) для одновалентных ионов − 140; для двухвалентных – 1,98; для трехвалентных – 0,052.
Решение
Минимальное количество электролита, прибавляемого к золю, которое вызывает коагуляцию, называется порогом коагуляции (Ск, ммоль/дм3).
Порог коагуляции можно рассчитать по формуле:
Ск = 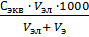
где С Экв – эквивалентная концентрация (молярная концентрация эквивалента), моль/дм3;
V эл., V з – объемы электролита и золя соответственно, дм3.
Выразим объем электролита:
Ск·  =
= 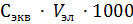
Ск· 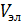 +Ск ·
+Ск ·  =
= 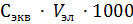
Ск·  =
= 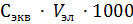 - Ск ·
- Ск · 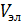
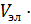 (
( - Ск) = Ск ·
- Ск) = Ск · 
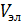 =
= 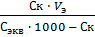
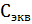 примем 1 н. раствор сульфата алюминия.
примем 1 н. раствор сульфата алюминия.
Предполагая, что знак электрических зарядов коллоидных частиц положительный, то коагулирующим действием будет обладать сульфат-ион, имеющий отрицательный заряд.
Тогда, расход Al2(SO4)3 для однозарядного золя составит:
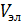 =
= 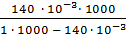 =0,14 м3
=0,14 м3
В пересчете на кг:
СН = 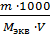
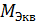 =
=  =
= 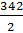 = 171 г-экв/моль
= 171 г-экв/моль
m = 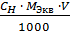 =
= 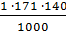 = 23,94 кг
= 23,94 кг
Расход Al2(SO4)3 для двузарядного золя составит:
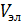 =
= 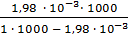 = 0,00198 м3
= 0,00198 м3
В пересчете на кг:
СН = 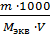
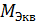 =
=  =
= 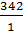 = 342 г-экв/моль
= 342 г-экв/моль
m = 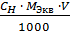 =
= 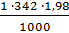 = 0,68 кг
= 0,68 кг
Расход Al2(SO4)3 для трехзарядного золя составит:
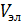 =
= 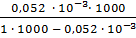 = 0,000052 м3
= 0,000052 м3
В пересчете на кг:
СН = 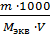
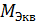 =
= 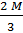 =
=  = 228 г-экв/моль
= 228 г-экв/моль
m = 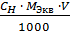 =
= 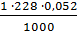 = 0,012 кг
= 0,012 кг
Суммарный расход электролита в кг составит:
Σm = 23,94 + 0,68 + 0,012 = 24,638 кг
Ответ. Расход сульфата алюминия на очистку 1000 м3 сточных вод составит 24,638 кг.
Задание №99. Какие процессы называются адгезией? Перечислите основные виды агдезии. Какова роль агдезии в процессах прилипания, склеивания, смачивания?
Ответ
Адге́зия (от лат. adhaesio- прилипание) в физике - сцепление поверхностей разнородных твёрдых и/или жидких тел. Адгезия обусловлена межмолекулярным взаимодействием (вандерваальсовым, полярным, иногда - образованием химических связей или взаимной диффузией) в поверхностном слое и характеризуется удельной работой, необходимой для разделения поверхностей. В некоторых случаях адгезия может оказаться сильнее, чем когезия, т. е. сцепление внутри однородного материала, в таких случаях при приложении разрывающего усилия происходит когезионный разрыв, т. е. разрыв в объёме менее прочного из соприкасающихся материалов.
Адгезия существенно влияет на природу трения соприкасающихся поверхностей: так, при трении поверхностей с низкой адгезией трение минимально. В качестве примера можно привести политетрафторэтилен (тефлон), который в силу низкого значения адгезии в сочетании с большинством материалов обладает низким коэффициентом трения. Некоторые вещества со слоистой кристаллической решёткой (графит, дисульфид молибдена), характеризующиеся одновременно низкими значениями адгезии и когезии применяются в качестве твёрдых смазок.
Адгезия имеет место в процессах склеивания, пайки, сварки, нанесения покрытий. Адгезия матрицы и наполнителя композитов (композиционных материалов) является также одним из важнейших факторов, влияющих на их прочность.
Адгезияиграет большую роль в таких процессах, как смачивание материалов, нанесение лакокрасочных и гальванических покрытий, получение материалов на основе связующих и наполнителей (бетон, резина, стеклопластики и др.), крашение, печатание, сварка и металлов.
Учитываются и используются адгезия и когезия в технологии лекарств, поскольку они влияют на взаимодействие компонентов в сложных лекарственных формах, на распадаемость таблеток, прочность покрытия их оболочками, на процессы растворения и в конечном итоге на эффективность терапевтического действия.
Задание №119. Дана система, состоящая из парообразного вещества и твердого пористого адсорбента, при температуре Т.
1. Постройте изотермы адсорбции и десорбции.
2. Определите тип сорбции, возможность гистерезиса адсорбции и капиллярной конденсации.
3. Рассчитайте пористость адсорбента по ветви десорбции, в случае ее отсутствия – ветви адсорбции.
4. Рассчитайте радиусы пор по уравнению Томсона-Кельвина и постройте интегральную и дифференциальную кривые распределения пор адсорбента по радиусам.
5. Определите тип адсорбента по величинам радиусов пор.
| Вариант | ТК | Адсорбент | Адсорбат | Р/РS | P · 10-2Па | А, моль\кг | |
| Адсорбция | Десорбция | ||||||
| Монтмориллорит | Н2О | - | 2,34 4,68 7,03 9,35 11,7 14,0 16,4 21,0 23,0 | 4,0 6,0 7,3 8,3 9,0 9,5 10,0 12,6 17,0 | 4,0 6,0 7,3 8,3 9,0 11,0 11,6 14,0 17,0 |
Решение
1. Изотерма адсорбции – нижняя кривая, изотерма десорбции – верхняякривая. Несовпадения изотерм адсорбции и десорбции свидетельствуют о наличии явления, называемого гистерезисом адсорбции.
2. Явление гистерезиса не наблюдается. Вид сорбции – капиллярная конденсация. Адсорбция воды на монтмориллоритене относится по классификационным признакам к молекулярной, физико-химической, протекающей на границе газ-твердое тело, помеханизму – полимолекулярная адсорбция.
3. Для построения изотермы адсорбции в координатах линейной формы уравнений Ленгмюра и Фрейндлиха пересчитаем величины адсорбции и давления в соответствии с требуемыми координатами. Результаты расчета представлены в виде таблицы 1.
Таблица 1
| р, Па | А | Д | lg P | p/A | lg A | P/Д | lg Д |
| 2,369216 | 58,5 | 0,60206 | 58,5 | 0,60206 | |||
| 2,670246 | 0,778151 | 0,778151 | |||||
| 7,3 | 7,3 | 2,846955 | 96,30137 | 0,863323 | 96,30137 | 0,863323 | |
| 8,3 | 8,3 | 2,970812 | 112,6506 | 0,919078 | 112,6506 | 0,919078 | |
| 3,068186 | 0,954243 | 0,954243 | |||||
| 9,5 | 9,5 | 3,146128 | 147,3684 | 0,977724 | 147,3684 | 0,977724 | |
| 3,214844 | |||||||
| 12,6 | 12,6 | 3,322219 | 166,6667 | 1,100371 | 166,6667 | 1,100371 | |
| 3,361728 | 135,2941 | 1,230449 | 135,2941 | 1,230449 |
Построим графики Р/А = f (Р) и lgА = f (lg P) и Р/А = f (Р) и lgА = f (lg P)
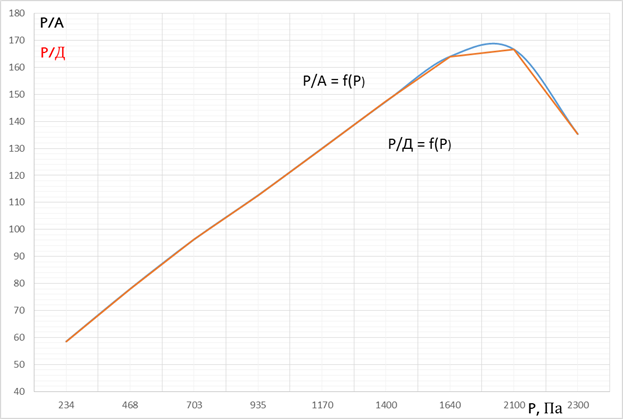
Рисунок 1 – Графики зависимости Р/А = f(P) и Р/Д = f(P)
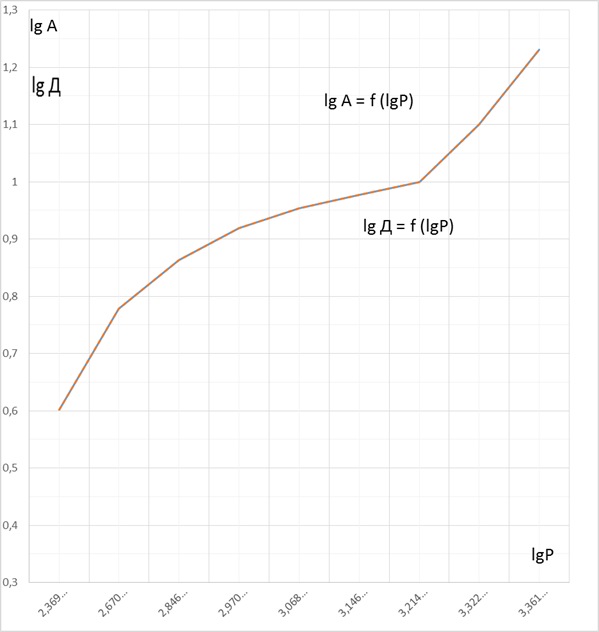
Рисунок 2 – График зависимости lgA = f (lgP) и lgД = f (lgP)
На сорбенте в момент сорбции происходит десорбция, то есть вода даже не смачивает сорбент.
Расчеты пористости адсорбента и радиусов пор проводятся по следующим формулам:
Wп = А·Vm
Vm = 
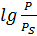 =
= 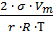 –уравнение Томсона – Кельвина
–уравнение Томсона – Кельвина
где Wп – пористость адсорбента, м3/кг;
А – адсорбция, моль, кг;
Vm – молярный объем адсорбата, м3/моль;
М – молярная масса адсорбата, кг/моль;
ρ – плотность адсорбата, кг/м3;
Р – давление паров адсорбата при данной температуре, Па;
Рs – давление насыщенных паров адсорбата при данной температуре, Па;
б – поверхностное натяжение адсорбата, Дж/м2;
r – радиус пор адсорбента, м;
R – универсальная газовая постоянная, Дж/(моль·К);
Т – температура, К.
Рассчитываем пористость Wп и радиус пор r при различных значениях адсорбции воды на монтмориллорите. Для воды находим из справочника:
ρ = 1000 кг/м3; М = 18,0 ·10-3 кг/моль;
σ = 72,5·10-3 Дж/м2;Рs = 23,4·104 Па.
Рассчитываем по приведенным формулам Vm, Wп и r для Р·10-2, Па.
Vm=  =
= 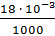 = 0,018 · 10-3 м3/моль
= 0,018 · 10-3 м3/моль
Wп = А·Vm
 =
=  – радиус под адсорбента
– радиус под адсорбента
Результаты представлены в таблице 2.
Таблица 2
| р, Па | А | P/Ps | Wn | lg(p/Ps) | r, м | r, нм |
| 0,001 | 0,000072 | 6,907755 | 1,55105E-10 | 15,5 | ||
| 0,002 | 0,000108 | 6,214608 | 1,72405E-10 | 17,2 | ||
| 7,3 | 0,003004 | 0,000131 | 5,80772 | 1,84483E-10 | 18,4 | |
| 8,3 | 0,003996 | 0,000149 | 5,52253 | 1,9401E-10 | 19,4 | |
| 0,005 | 0,000162 | 5,298317 | 2,0222E-10 | 20,2 | ||
| 9,5 | 0,005983 | 0,000171 | 5,118849 | 2,0931E-10 | 20,9 | |
| 0,007009 | 0,00018 | 4,960625 | 2,15986E-10 | 21,6 | ||
| 210Δ0 | 12,6 | 0,008974 | 0,000227 | 4,713384 | 2,27316E-10 | 22,7 |
| 0,009829 | 0,000306 | 4,622412 | 2,3179E-10 | 23,8 |
Общая пористость адсорбента Wп складывается из объема пор разных радиусов r. Чтобы узнать, поры каких радиусов преобладают в адсорбенте, необходимо построить интегральную (Wп – r) и дифференциальную (ΔWп /Δr) – r кривыераспределения пор по радиусам.
Таблица 3
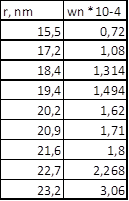
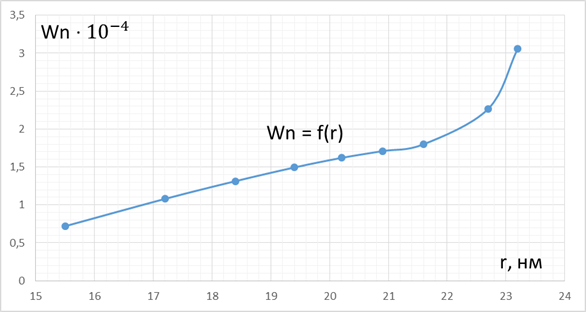
Рисунок 3 – Интегральная кривая распределения
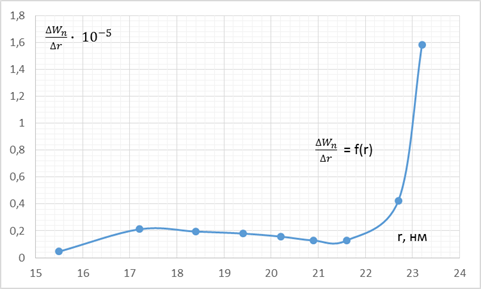
Рисунок 4 – Дифференциальная кривая распределения
Задание №139. Для полного обессоливания методом ионообменной адсорбции V м3 природной или разбавленной сточной воды последовательно пропускают чMерез колонки с m1 кг катионита в Н-форме и с m2 кг анионита в ОН- форме.
Динамические обменные емкости катионита равны: А кг катионита моль -экв соли; В кг к анионита моль -экв соли. Охарактеризуйте процесс ионообменной адсорбции из воды на ионитах (варианты заданий приведены в табл. 5).
1. Напишите уравнения ионообменных реакций, протекающих на катионите и анионите с участием ионов каждой соли.
2. Определите, в какой последовательности будут адсорбироваться ионы на катионите и анионите. Расположив их в ряд по уменьшению адсорбируемости.
3. Пересчитайте концентрацию солей в водном растворе, выраженную в г/л, в молярную концентрацию эквивалентов (моль экв/л) и определите суммарную концентрацию солей в (моль экв/л).
4. рассчитайте искомые величины х, указанные в варианте задания.
5. Предложите методы регенерации отработанных катионитов и анионитов и напишите уравнения соответствующих ионообменных реакций.
| Вариант | m1, кг | m2, кг | А, 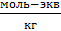
| В, 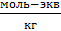
| V, м3 | Солевой состав водного раствора | |
| Формула соли | С, г/л | ||||||
| х | х | 4,0 | 4,2 | Pb(NO3)2 AgNO3 Hg(NO3)2 Al(NO3)3 | 0,01 0,04 0,021 0.012 |
Решение
1. Уравнения ионообменных реакций имеют вид:
2 R-H + Pb(NO3)2 = PbR2 + 2 HNO3 на катионите
2 R-H + HgSO4 = HgR2 + H2SO4 на катионите
3 R-H + Al(NO3)3 = AIR3 + 3 HNO3накатионите
R-Н + AgNO3 = AgR + HNO3 на катионите
R-OH + HNO3 = RNO3 + H2O на анионите
2. В соответствии с закономерностями адсорбции на катионите адсорбируется в первую очередь ион алюминия, потом затем ионы ртути и свинца, в самом конце – ионы серебра, на анионите – нитрат-ион.
3. Обмен ионов протекает в эквивалентных количествах, поэтому вначале пересчитываем концентрацию С, выраженную в г/л, в молярную концентрацию эквивалентов Сэк по формуле:
Сэк = 
где Мэк – молярная масса эквивалентов, г/моль;
Zэк– число эквивалентности, равное заряду иона по модулю.
Сэк(AI(NO3)3) = 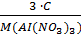 =
= 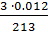 = 1,69 · 10-4 моль/л
= 1,69 · 10-4 моль/л
Сэк(Pb(NO3)2) = 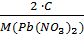 =
= 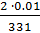 = 0,6· 10-4 моль/л
= 0,6· 10-4 моль/л
Сэк(HgSO4) =  =
=  = 1,42 · 10-4 моль/л
= 1,42 · 10-4 моль/л
Сэк(AgNO3) =  =
=  = 2,35 · 10-4 моль/л
= 2,35 · 10-4 моль/л
По закону эквивалентов:
Сэк(AI(NO3)3) = Сэк(AI3+) = Сэк(NO3-)
Сэк(Pb(NO3)2) = Сэк(Pb2+) = Сэк(NO3-)
Сэк(Hg(NO3)2) = Сэк(Hg2+) = Сэк(NO3-)
Сэк(AgNO3) = Сэк(Ag+) = Сэк(NO3-)
Определяем ΣСэк – суммарная молярная концентрация эквивалентов всех катионитов или всех анионитов, моль/л
Катионы:
ΣСэк = Сэк(AI3+) + Сэк(Pb2+) + Сэк(Hg2+) + Сэк(Ag+)
ΣСэк = (1,69 + 0,6 + 1,42 + 2,35) · 10-4 = 6,06 · 10-4 моль/л
Анионы:
ΣСэк = Сэк(NO3-) + Сэк(NO3-) + Сэк(NO3-) + Сэк(NO3-)
ΣСэк = (1,69 + 0,6 + 1,42 + 2,35) · 10-4 = 6,06 · 10-4 моль/л
4. По величине динамической обменной емкости ионита Q рассчитываем не хватающую величину в таблицеm1иm2.
Для катионита:
Q = 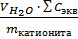
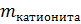 =
= 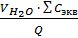 =
= 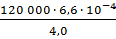 = 19,8 кг ~ 20 кг
= 19,8 кг ~ 20 кг
Для анионита:
Q = 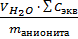
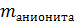 =
= 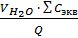 =
= 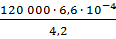 = 18,86 кг ~ 19 кг
= 18,86 кг ~ 19 кг
5. С целью многократного использования ионитов их можно регенерировать путем проведения ионообменной адсорбции в обратном направлении, т. е. через катионит пропустить раствор кислоты, а через анионит – раствор щелочи.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Тихоокеанский государственный университет»
Кафедра «Химии»
Контрольная работа
по дисциплине «КОЛЛОИДНАЯ ХИМИЯ. ПОВЕРХНОСТНЫЕ
ЯВЛЕНИЯ И ДИСПЕРСНЫЕ СИСТЕМЫ »
Шифр 150010548
Выполнил студент гр. ООСзу-51 Смирнов владислав Евгнньевич
Проверил руководитель: Яргаева В.А.
Хабаровск 2017