ГЛАВА 10 АНТИГЕНЫИ ИММУННАЯ СИСТЕМА ЧЕЛОВЕКА
Антигены
Общие сведения
Жизнедеятельность каждого макроорганизма проходит в непосредственном контакте с чужеродными для него клетками, доклеточными формами жизни и отдельными биоорганическими молекулами. Будучи чужеродными, эти объекты таят в себе огромную опасность, так как могут нарушить гомеостаз, повлиять на течение биологических процессов в макроорганизме и даже повлечь его гибель. Контакт с чужеродными биологическими объектами представляет собой ранний сигнал опасности для иммунной системы, они являются основным раздражителем и объектом системы приобретенного иммунитета. Такие объекты получили название антигенов (от греч. anti - против, genos - создавать).
Современное определение термина «антиген» - это биополимер органической природы, генетически чужеродный для макроорганизма, который при попадании в последний распознается его иммунной системой и вызывает иммунные реакции, направленные на его устранение. Учение об антигенах является ключевым для понимания основ молекулярно-генетических механизмов иммунной защиты макроорганизма, так как антиген является движущей силой иммунного ответа, а также принципов иммунотерапии и иммунопрофилактики.
Антигены имеют разнообразное происхождение. Они являются продуктом природного биологического синтеза любого чужеродного организма, могут образовываться в собственном организме при структурных изменениях уже синтезированных молекул в ходе биодеградации, нарушении их нормального биосинтеза или генетической мутации клеток. Кроме того, антигены могут быть по-
лучены искусственно в результате научной работы или путем направленного химического синтеза. Однако в любом случае молекулу антигена будет отличать генетическая чужеродность по отношению к макроорганизму, в который она попала. Теоретически антигеном может быть молекула любого органического соединения.
Антигены могут попадать в макроорганизм самыми разными путями: через кожные покровы или слизистые оболочки, непосредственно во внутреннюю среду организма, минуя покровы или образовываясь внутри него. При попадании в макроорганизм антигены распознаются иммунокомпетентными клетками и вызывают каскад разнообразных иммунных реакций, направленных на их инактивацию, разрушение и удаление.
Свойства антигенов
Характерными свойствами антигенов являются антигенность, иммуногенность и специфичность.
Антигенность - это потенциальная способность молекулы антигена активировать компоненты иммунной системы и специфически взаимодействовать с факторами иммунитета (антитела, клон эффекторных лимфоцитов). При этом компоненты иммунной системы взаимодействуют не со всей молекулой антигена, а только с ее небольшим участком, который получил название антигенной детерминанты, или эпитопа.
Различают линейные, или секвенциальные, антигенные детерминанты, например первичная аминокислотная последовательность пептидной цепи, и поверхностные, или конформационные, расположенные на поверхности молекулы антигена и возникшие в результате вторичной или более высокой конформации. На концевых участках молекулы антигена расположены концевые эпитопы, а в центре молекулы - центральные. Существуют также глубинные, или скрытые, антигенные детерминанты, которые проявляются при разрушении биополимера.
Размер антигенной детерминанты невелик. Он определяется характеристиками рецепторной части фактора иммунитета и структурой эпитопа. Например, антигенсвязывающий участок молекулы иммуноглобулина способен распознать линейную антигенную детерминанту, состоящую из 5 аминокислотных остатков. Для образования конформационной детерминанты требуется 6-12 аминокислотных остатков. Рецепторному аппарату Т-киллера для
определения чужеродности требуется нанопептид, включенный в состав MHC I класса, Т-хелперу - олигопептид размером 12- 25 аминокислотньгх остатков в комплексе с MHC II класса.
Молекулы большинства антигенов имеют довольно большие размеры. В их структуре определяется множество антигенных детерминант, которые распознаются разными по специфичности антителами и клонами лимфоцитов. Поэтому антигенность вещества зависит от наличия и числа антигенных детерминант в структуре его молекулы.
Структура и состав эпитопа имеют критическое значение. Замена хотя бы одного структурного компонента молекулы приводит к образованию принципиально новой антигенной детерминанты. Денатурация приводит к потере имеющихся антигенных детерминант или появлению новых, а также специфичности.
Чужеродность является обязательным условием для реализации антигенности. Понятие «чужеродность» относительное, так как иммунокомпетентные клетки не способны напрямую анализировать чужеродный генетический код, а лишь продукты, синтезированные с чужеродной генетической матрицы. В норме иммунная система невосприимчива к собственным биополимерам, если он не приобрел черты чужеродности. Кроме того, при некоторых патологических состояниях в результате нарушения регуляции иммунного ответа (см. аутоантигены, аутоантитела, аутоиммунитет, аутоиммунные болезни) собственные биополимеры могут восприниматься иммунной системой как чужие.
Чужеродность находится в прямой зависимости от эволюционного расстояния между организмом и источником антигенов. Чем дальше в таксономическом плане организмы отстоят друг от друга, тем большей чужеродностью и, следовательно, иммуногенностью обладают их антигены. Чужеродность заметно проявляется даже между особями одного вида, так как замена хотя бы одной аминокислоты эффективно распознается антителами в серологических реакциях.
Вместе с тем антигенные детерминанты даже генетически неродственных существ или веществ могут иметь определенное подобие и способны специфически взаимодействовать с одними и теми же факторами иммунитета. Такие антигены получили название перекрестно реагирующих. Обнаружено также сходство антигенных детерминант стрептококка, сарколеммы миокарда и базальной
мембраны почек, Treponemapallidum и липидной вытяжки из миокарда крупного рогатого скота, возбудителя чумы и эритроцитов человека 0(I) группы крови. Явление, когда один организм маскируется антигенами другого для защиты от факторов иммунитета, получило название антигенной мимикрии.
10.1.2.1. Иммуногенность
Иммуногенность - потенциальная способность антигена вызывать по отношению к себе в макроорганизме специфический продуктивный ответ. Иммуногенность зависит от трех групп факторов: молекулярных особенностей антигена, кинетики антигена в организме, реактивности макроорганизма.
К первой группе факторов отнесены природа, химический состав, молекулярная масса, структура и некоторые другие характеристики.
Природа антигена в значительной степени определяет иммуногенность. Наиболее выраженной иммуногенностью обладают белки и полисахариды, наименьшей - нуклеиновые кислоты и липиды. В то же время их сополимеры - липополисахариды, гликопротеиды, липопротеиды - способны в достаточной мере активировать иммунную систему.
Иммуногенность в определенной мере зависит от химического состава молекулы антигена. Для белковых антигенов важно разнообразие их аминокислотного состава. Монотонные полипептиды, построенные из одной аминокислоты, практически не активируют иммунную систему. Наличие в структуре молекулы белка ароматических аминокислот, таких, как тирозин, триптофан, существенно повышает иммуногенность.
Важна оптическая изомерия структурных компонентов молекулы антигена. Пептиды, построенные из L-аминокислот, высокоиммуногенны. Полипептидная цепочка, построенная из правовращающих изомеров аминокислот, напротив, может проявлять ограниченную иммуногенность при введении в малых дозах.
В спектре иммуногенности существует определенная иерархия антигенных детерминант: эпитопы различаются по способности индуцировать иммунный ответ. При иммунизации некоторым антигеном будут преобладать реакции к отдельным антигенным детерминантам. Это явление получило название иммунодоминантности. По современным представлениям она обусловлена различиями в сродстве эпитопов к рецепторам антигенпрезентирующих клеток.
Большое значение имеют размер и молекулярная масса антигена. Небольшие полипептидные молекулы с массой менее 5 кД, как правило, низкоиммуногенны. Олигопептид, способный индуцировать иммунный ответ, должен состоять из 6-12 аминокислотных остатков и иметь молекулярную массу около 450 Д. С увеличением размера пептида возрастает его иммуногенность, однако эта зависимость на практике не всегда выполняется. Так, при равной молекулярной массе (около 70 кД) альбумин является более сильным антигеном, чем гемоглобин.
Опытным путем было доказано, что высокодисперсные коллоидные растворы антигена плохо индуцируют иммунный ответ. Гораздо большей иммуногенностью обладают агрегаты молекул и корпускулярные антигены - цельные клетки (эритроциты, бактерии и т.д.). Это связано с тем, что корпускулярные и высокоагрегированные антигены лучше фагоцитируются, чем отдельные молекулы.
Оказалась также существенной стерическая стабильность молекулы антигена. При денатурации белков до желатина вместе с конформационной жесткостью теряется иммуногенность. Поэтому растворы желатина широко используются для парентерального введения.
Важным условием иммуногенности является растворимость антигена. Например, высокомолекулярные соединения кератин, меланин, натуральный шелк и др. нерастворимы в воде, не образуют коллоидных растворов в нормальном состоянии и не являются иммуногенами. Благодаря этому свойству конский волос, шелк, кетгут и др. прменяют в клинической практике для сшивания органов и тканей.
Вторая группа факторов связана с динамикой поступления антигена в организм и его выведения. Так, хорошо известна зависимость иммуногенности антигена от места и способа его введения, что обусловлено особенностями строения иммунной системы в местах интервенции антигена.
Сила иммунного ответа зависит от количества поступающего антигена: чем его больше, тем выраженнее иммунная реакция макроорганизма.
Третья группа объединяет факторы, определяющие зависимость иммуногенности от состояния макроорганизма: наследственности и функциональных характеристик. Хорошо известно, что резуль-
тат иммунизации в определенной мере связан с генотипом особи. Существуют чувствительные и нечувствительные к определенным антигенам роды и виды животных. Например, кролики и крысы практически не реагируют на некоторые бактериальные антигены, которые могут вызывать у морской свинки или мыши чрезвычайно бурный иммунный ответ.
10.1.2.2. Специфичность
Специфичностью называют способность антигена индуцировать иммунный ответ к строго определенному эпитопу. Специфичность антигена во многом определяется свойствами составляющих его эпитопов.
Классификация антигенов
Основываясь на отдельных характерных свойствах, все многообразие антигенов можно классифицировать по происхождению, природе, молекулярной структуре, степени иммуногенности, степени чужеродности, направленности активации и обеспеченности иммунного реагирования.
По происхождению различают экзогенные (возникшие вне организма) и эндогенные (возникшие внутри организма) антигены. Среди эндогенных особого внимания заслуживают ауто- и неоантигены. Аутогенные антигены (аутоантигены) - это структурно неизмененные антигены собственного организма, синтезируемые в организме в физиологических условиях. В норме аутоантигенынеиммуногенны вследствие сформировавшейся иммунологической толерантности (невосприимчивости) либо их недоступности для контакта с факторами иммунитета - это так называемые забарьерные антигены. При срыве толерантности или нарушении целостности биологических барьеров (воспаление, травма) компоненты иммунной системы начинают специфически реагировать на аутоантигены выработкой специфических факторов иммунитета (аутоантитела, клон аутореактивных лимфоцитов). Неоантигены, в отличие от аутоантигенов, возникают в организме в результате генетических мутаций или модификаций и всегда чужеродны.
По природе: биополимеры белковой (протеиды) и небелковой (полисахариды, липиды, липополисахариды, нуклеиновые кислоты и др.) природы.
По молекулярной структуре: глобулярные (молекула имеет шаровидную форму) и фибриллярные (форма нити).
По степени иммуногенности: полноценные и неполноценные. Полноценные антигены обладают выраженной антигенностью и иммуногенностью - иммунная система чувствительного организма реагирует на их введение выработкой факторов иммунитета. Такие вещества, как правило, имеют достаточно большую молекулярную массу (более 10 кД), большой размер молекулы (частицы) в виде глобулы и хорошо взаимодействуют с факторами иммунитета.
Неполноценные антигены, или гаптены (термин предложен К. Ландштейнером), обладают антигенностью - способны специфически взаимодействовать с уже готовыми факторами иммунитета (антителами, лимфоцитами), но не способны при введении в нормальных условиях индуцировать в организме иммунный ответ. Чаще всего гаптенами являются низкомолекулярные соединения (молекулярная масса менее 10 кД).
Если искусственно укрупнить молекулу гаптена - соединить ее прочной связью с достаточно большой белковой молекулой, удается заставить иммунную систему макроорганизма специфически реагировать на гаптен как на полноценный антиген и вырабатывать факторы иммунитета. Молекула белка-носителя получила название шлеппера (тягача). При этом специфичность в составе молекулы конъюгата определяется гаптенной частью, а иммуногенность - белком-носителем. Используя для иммунизации конъюгаты, получают антитела к гормонам, лекарственным препаратам и другим низкоиммуногенным соединениям.
По степени чужеродности: ксено-, алло- и изоантигены. Ксеногенные антигены (или гетерологичные) - общие для организмов, стоящих на разных ступенях эволюционного развития, например, относящиеся к разным родам и видам. Впервые феномен общности ряда антигенов у животных разных видов был отмечен Д. Форсманом (1911 г.). При иммунизации кролика суспензией органов морской свинки ученый получил иммунную сыворотку, способную взаимодействовать с эритроцитами барана. Позже было установлено, что морская свинка и баран имеют ряд структурно сходных антигенных детерминант, дающих перекрестное реагирование. В дальнейшем перечень подобных ксеногенных антигенов был значительно расширен и они получили обобщенное название «антигены Форсмана».
Аллогенные антигены (или групповые) - общие для генетически неродственных организмов, но относящихся к одному виду. На основании аллоантигенов общую популяцию организмов можно подразделить на отдельные группы. Примером таких антигенов у людей являются антигены групп крови (системы АВ0 и др.). Аллогенные ткани при трансплантации иммунологически несовместимы - они отторгаются или лизируются реципиентом. Микробы на основании групповых антигенов могут быть подразделены на серогруппы, что используется в микробиологической диагностике.
Изогенные антигены (или индивидуальные) - общие только для генетически идентичных организмов, например для однояйцовых близнецов, инбредных линий животных. Изотрансплантаты обладают практически полной иммунной совместимостью и не отторгаются. К изоантигенам у людей относятся антигены гистосовместимости, а у бактерий - типовые антигены, не дающие дальнейшего расщепления.
В пределах отдельного организма в определенных органах или тканях обнаруживаются специфичные для них антигены, которые нигде больше не встречаются. Такие антигены получили название органо- и тканеспецифических.
В зависимости от физико-химических свойств антигена, условий его внедрения, характера реакции и реактивности макроорганизма различают иммуногены, толерогены и аллергены. Иммуногены способны индуцировать нормальную продуктивную реакцию иммунной системы - выработку факторов иммунитета (антитела, антигенореактивные клоны лимфоцитов). В клинической практике иммуногены используют для иммунодиагностики, иммунотерапии и иммунопрофилактики многих патологических состояний.
Толероген является полной противоположностью иммуногену. Он формирует иммунологическую толерантность или неотвечаемость на эпитопы данного вещества (см. раздел 11.6). Толероген, как правило, - мономер с низкой молекулярной массой, высокой эпитопной плотностью и высокой дисперсностью. Толерогены используют для профилактики и лечения иммунологических конфликтов и аллергии путем наведения искусственной неотвечаемости на отдельные антигены.
Аллерген, в отличие от иммуногена, формирует патологическую реакцию организма в виде гиперчувствительности немедленного или замедленного типа (см. раздел 11.4). По своим свойствам
аллерген не отличается от иммуногена. В клинической практике аллергены применяют для диагностики инфекционных и аллергических заболеваний.
По направленности активации и обеспеченности иммунного реагирования, т.е. необходимости вовлечения Т-лимфоцитов в индукцию иммунного ответа, выделяют Т-зависимые и Т-независимые антигены. Иммунная реакция в ответ на введение Т-зависимого антигена реализуется при обязательном участии Т-хелперов. К ним относится большая часть известных антигенов. Для развития иммунного ответа на Т-независимые антигены не требуется привлечение Т-хелперов. Эти антигены способны непосредственно стимулировать В-лимфоциты кантителопродукции, дифференцировке и пролиферации, а также вызывать иммунный ответ у бестимусных животных. Т-независимые антигены имеют относительно простое строение. Это крупные молекулы с молекулярной массой более 103 кД, поливалентны и имеют многочисленные однотипные эпитопы. Т-независимые антигены являются митогенами и поликлональными активаторами, например полимерный флагеллин (сократительный белок жгутиков бактерий), липополисахарид, туберкулин и др.
От Т-независимых антигенов следует отличать суперантигены. Это группа веществ, в основном микробного происхождения, которые могут неспецифически вызывать поликлональную реакцию. Молекула суперантигена способна вмешиваться в кооперацию антигенпрезентирующей клетки и Т-хелпера и формировать ложный сигнал распознавания чужеродной субстанции.
Суперантигены способны одновременно неспецифически активировать огромное количество иммунокомпетентных клеток (до 20% и более), вызывать гиперпродукциюцитокинов и низкоспецифичных иммуноглобулинов, массовую гибель лимфоцитов вследствие апоптоза и развитие вторичного функционального иммунодефицита. Свойства суперантигена обнаружены у стафилококкового энтеротоксина, белков вирусов Эпштейна-Барр, бешенства, ВИЧ и некоторых других микробных агентов.
Антигены организма человека
Начало изучению аллоантигенных свойств тканей было положено К. Ландштайнером, который в 1901 г. открыл систему групповых антигенов эритроцитов (АВ0). В организме человека
выделяют множество разнообразных антигенов. Они не только нужны для полноценного развития и функционирования всего организма в целом, но также несут важную информацию при клинико-лабораторной диагностике, определении иммунной совместимости органов и тканей в трансплантологии, а также в научных исследованиях. Наибольший медицинский интерес из числа аллогенных антигенов представляют антигены групп крови, среди изогенных - антигены гистосовместимости, а в группе органо- и тканеспецифических - раково-эмбриональные антигены.
10.1.4.1. Антигены групп крови человека
Антигены групп крови человека располагаются на цитоплазматической мембране клеток, но наиболее легко определяются на поверхности эритроцитов. Поэтому они получили название «эритроцитарные антигены». На сегодняшний день известно более 250 различных эритроцитарных антигенов. Однако наиболее важное клиническое значение имеют антигены системы АВ0 и Rh (резус-фактор): их необходимо учитывать при проведении переливания крови, пересадке органов и тканей, предупреждении и лечении иммуноконфликтных осложнений беременности и т.д.
Антигены системы АВ0 обнаруживаются в плазме крови, лимфе, секретах слизистых оболочек и других биологических жидкостях, но наиболее выражены на эритроцитах. Они синтезируются многими клетками организма, включая ядросодержащие предшественники эритроцитов, и свободно секретируются в межклеточное пространство. На мембране клеток эти антигены могут появиться либо как продукт клеточного биосинтеза, либо в результате сорбции из межклеточных жидкостей.
Антигены системы АВ0 представляют собой высокогликозилированные пептиды: 85% приходится на углеводную часть и 15% - на полипептидную. Пептидный компонент состоит из 15 аминокислотных остатков. Он постоянен для всех групп крови АВ0 и иммунологически инертен. Иммуногенность молукулы антигена системы АВ0 определяется его углеводной частью.
В системе антигенов АВ0 выделяют три варианта антигенов, различающихся по строению углеводной части: Н, А и В. Базовой молекулой является антиген Н, специфичность которого определяют три углеводных остатка. Антиген А имеет в структуре дополнительный четвертый углеводный остаток - N-ацетил-D-галактозу, а антиген В - D-галактозу. Антигены системы АВ0 имеют неза-
висимое аллельное наследование, что определяет наличие в популяции 4 групп крови: 0(I), А(II), B(III) и АВ(IV). Кроме того, антигены А и В имеют несколько аллотипов (например, А1, А2, А3... или В1, В2, В3...), которые встречаются в популяции людей с разной частотой.
Антигены системы АВ0 определяют в реакции агглютинации. Однако, учитывая высокий популяционный полиморфизм данной антигенной системы, перед гемотрансфузией обязательно проводят биологическую пробу на совместимость крови реципиента и донора. Ошибка в определении групповой принадлежности и переливание пациенту несовместимой по группе крови приводят к развитию острого внутрисосудистого гемолиза.
Другой важнейшей системой эритроцитарных антигенов является система резус-антигенов (Rh) или резус-факторов. Эти антигены синтезируются предшественниками эритроцитов и обнаруживаются главным образом на эритроцитах, так как они водонерастворимы. Резус-антиген представляет собой термолабильный липопротеид. Выделяют 6 разновидностей этого антигена. Генетическая информация о его строении закодирована в многочисленных аллелях трех сцепленных между собой локусов (D/d, C/c, E/e). В зависимости от наличия или отсутствия резус-антигена в популяции людей различают две группы: резус-положительных и резус-отрицательных индивидуумов.
Совпадение по резус-антигену важно не только при переливании крови, но также для течения и исхода беременности. При беременности резус-отрицательной матери резус-положительным плодом может развиться резус-конфликт. Это патологическое состояние связано с выработкой антирезусных антител, способных вызвать иммунологический конфликт: невынашивание беременности или желтуху новорожденного (внутрисосудистый иммунный лизис эритроцитов).
Вследствие того что плотность резус-антигена на мембране эритроцитов невысока и его молекула обладает слабой антигенностью, резус-фактор определяют на мембране эритроцитов в реакции непрямой агглютинации (реакция Кумбса).
10.1.4.2. Антигены гистосовместимости
На цитоплазматических мембранах практически всех клеток макроорганизма обнаруживаются антигены гистосовместимости. Большая часть из них относится к системе главного комплекса
гистосовместимости, или MHC (от англ. MainHystocompatibilityComplex). Установлено, что антигены гистосовместимости играют ключевую роль в осуществлении специфического распознавания «свой-чужой» и индукции приобретенного иммунного ответа, определяют совместимость органов и тканей при трансплантации в пределах одного вида и другие эффекты. Большая заслуга в изучении MHC принадлежит Дж. Доссе, П. Догерти, П. Гореру, Г. Снеллу, Р. Цинкернагелю, Р.В. Петрову, ставшими основоположниками иммуногенетики.
Впервые MHC был обнаружен в 60-х годах ХХ века в опытах на генетически чистых (инбредных) линиях мышей при попытке межлинейной пересадки опухолевых тканей (П. Горер, Г. Снелл). У мышей этот комплекс получил название Н-2 и был картирован в 17-й хромосоме.
У человека MHC был описан несколько позже в работах Дж. Доссе. Его обозначили как HLA (от англ. HumanLeukocyteAntigen), так как он ассоциирован с лейкоцитами. Биосинтез HLA определяется генами, локализованными сразу в нескольких локусах короткого плеча 6-й хромосомы.
MHC имеет сложную структуру и высокую полиморфность. Антигены гистосовместимости представляют собой гликопротеины, прочно связанные с цитоплазматической мембраной клеток. Их отдельные фрагменты имеют структурное сходство с молекулами иммуноглобулинов и поэтому относятся к единому суперсемейству. Различают два основных класса молекул MHC (I и II), которые объединяют множество сходных по структуре антигенов, кодируемых множеством аллельных генов. На клетках индивидуума могут одновременно экспрессироваться не более двух разновидностей продуктов каждого гена MHC. MHC I класса индуцирует преимущественно клеточный иммунный ответ, а MHC II класса - гуморальный.
MHC I класса состоит из двух нековалентно связанных полипептидных цепей (α и β) с разной молекулярной массой (рис. 10.1). α-Цепь имеет внеклеточный участок с доменным строением (α1-, α2- и а3-домены), трансмембранный и цитоплазматический. β-Цепь представляет собой β2-микроглобулин, адгезированный на α,,-домен после экспрессии α-цепи на цитоплазматической мембране клетки. α1- и α2-Домены α-цепи формируют щель Бъеркмана - участок, ответственный за сорбцию и презентацию молекул
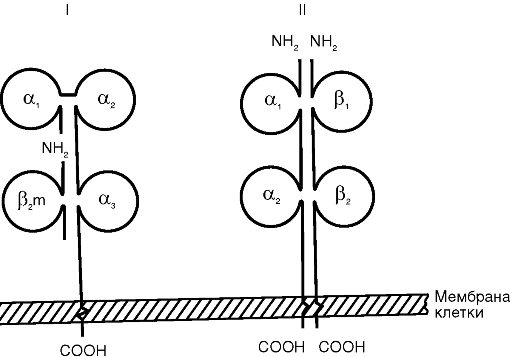 Рис. 10.1. Схема строения антигенов главного комплекса гистосовместимости: I - МНС I класса; II - МНС II класса
Рис. 10.1. Схема строения антигенов главного комплекса гистосовместимости: I - МНС I класса; II - МНС II класса
антигена. Щель Бъеркмана MHC I класса вмещает нанопептид, который легко выявляется специфическими антителами.
Сборка комплекса MHC I класса - антиген протекает внутриклеточно непрерывно в эндоплазматическом ретикулуме. В его состав включаются любые эндогенно синтезированные пептиды, в том числе вирусные, куда они переносятся из цитоплазмы при помощи особого белка, протеосомы. Включенный в комплекс пептид придает структурную устойчивость MHC I класса. В его отсутствие функцию стабилизатора выполняет шаперон (калнексин).
MHC I класса экспрессируются на поверхности практически всех клеток, кроме эритроцитов и клеток ворсинчатого трофобласта (профилактика отторжения плода). Плотность MHC I класса достигает 7000 молекул на клетку, и они покрывают около 1% ее поверхности. Для них характерна высокая скорость биосинтеза - процесс завершается за 6 ч. Экспрессия MHC I класса усиливается под влиянием цитокинов, например γ-интерферона.
В настоящее время у человека различают более 200 различных вариантов HLA I класса. Они кодируются генами, картированными
в трех основных сублокусах 6-й хромосомы и наследуются и проявляются независимо: HLA-A, HLA-B и HLA-C. Локус А объединяет более 60 вариантов, В - 130, а С - около 40. Независимое наследование генов сублокусов в популяции формирует бесконечное множество неповторяющихся комбинаций HLA I класса. Каждый человек строго уникален по набору антигенов гистосовместимости, исключение составляют только однояйцовые близнецы. Основная биологическая роль HLA I класса - они определяют биологическую индивидуальность (биологический паспорт) и являются маркерами «своего» для иммунокомпетентных клеток. Заражение клетки вирусом или ее мутация изменяют структуру HLA I класса, что является сигналом для активации Т-киллеров (CD8+-лимфоциты) к уничтожению объекта.
HLA I класса выявляют на лимфоцитах в реакции микролимфоцитолиза со специфическими сыворотками, которые получают от многорожавших женщин, пациентов после массивной гемотрансфузии, а также с использованием моноклональных антител.
В структуре и функции MHC II класса есть ряд принципиальных отличий. Комплекс образован двумя нековалентно связанными полипептидными цепями (α и β), имеющими сходное доменное строение (см. рис. 10.1). Обе цепи являются трансмембранными пептидами и «заякорены» в цитоплазматической мембране. Щель Бъеркмана в MHC II класса образована одновременно обеими цепями. Она вмещает олигопептид размером 12-25 аминокислотных остатков, недосягаемый специфическими антителами. MHC II класса включает в себя пептид, захваченный из внеклеточной среды путем эндоцитоза, а не синтезированный самой клеткой. Молекулы МНС II класса экспрессируются на поверхности ограниченного числа клеток: дендритных, В-лимфоцитах, Т-хелперах, активированных макрофагах, тучных, эпителиальных и эндотелиальных клетках. Обнаружение MHC II класса на нетипичных клетках расценивается в настоящее время как иммунопатология. Биосинтез MHC II класса протекает в эндоплазматическом ретикулуме и экспрессируется на цитоплазматической мембране клетки в течение 1 ч после эндоцитоза антигена. Экспрессия комплекса может быть усилена γ-интерфероном и снижена простагландином Е2.
У мыши антиген гистосовместимости получил название Ia- антигена, а у человека по аналогии - HLA II класса.
По имеющимся данным, человеческому организму свойствен чрезвычайно высокий полиморфизм HLA II класса, который в большей степени определяется особенностями строения β-цепи. В состав комплекса входят продукты трех основных локусов: HLA- DR, DQ и DP. При этом локус DR объединяет около 300 аллельных форм, DQ - около 400, а DP - около 500.
Наличие и тип MHC II класса определяют в серологических (микролимфоцитотоксический тест) на В-лимфоцитах и клеточных реакциях иммунитета (смешанная культура лимфоцитов). Специфические антитела к MHC II класса получают так же, как и к I классу. Тестирование в смешанной культуре лимфоцитов позволяет выявить минорные компоненты MHC II класса, не определяемые серологически.
MHC II класса участвуют в индукции приобретенного иммунного ответа. Фрагменты молекулы антигена экспрессируются на цитоплазматической мембране особой группы клеток, которая получила название антигенпрезентирующих. Основными являются дендритная клетка, макрофаг и В-лимфоцит. Структура MHC II класса с включенным в него пептидом в комплексе с кофакторными молекулами CD-антигенов воспринимается и анализируется Т-хелперами (CD4+-лимфоциты). В случае распознавания чужеродности Т-хелпер начинает синтез соответствующих иммуноцитокинов, и включается механизм специфического иммунного реагирования: пролиферация и дифференцировка антигенспецифических клонов лимфоцитов.
Помимо описанных выше антигенов гистосовместимости, идентифицирован III класс молекул MHC. Локус, содержащий кодирующие их гены, вклинивается между I и II классами и разделяет их. К MHC III класса относятся некоторые компоненты комплемента (С2, С4), белки теплового шока, факторы некроза опухоли и др.
10.1.4.3. Опухольассоциированные антигены
В 1948-1949 гг. видный отечественный микробиолог и иммунолог Л.А. Зильбер при разработке вирусной теории рака доказал наличие антигена, специфичного для опухолевой ткани. Позже в 60-х годах ХХ века Г.И. Абелев (в опытах на мышах) и Ю.С. Татаринов (при обследовании людей) обнаружили в сыворотке крови больных первичным раком печени эмбриональный вариант сывороточного альбумина - α-фетопротеин. К настоящему моменту обнаружено и охарактеризовано множество опухольассоциирован-
ных антигенов. Однако не все опухоли содержат специфические маркерные антигены, равно как и не все маркеры обладают строгой тканевой специфичностью.
Опухольассоциированные антигены классифицируют по локализации и генезу. Различают сывороточные, секретируемые опухолевыми клетками в межклеточную среду, и мембранные. Последние получили название опухолеспецифических трансплантационных антигенов, или TSTA (от англ. Tumor-SpecificTransplantationAntigen).
Выделяют также вирусные, эмбриональные, нормальные гиперэкспрессируемые и мутантные опухольассоциированные антигены. Вирусные - являются продуктами онковирусов, эмбриональные в норме синтезируются в зародышевом периоде. Хорошо известен α-фетопротеин (эмбриональный альбумин), нормальный протеин тестикул (MAGE 1,2,3 и др.), маркеры меланомы, рака молочной железы и др. Хорионический гонадотропин, в норме синтезируемый в плаценте, обнаруживается при хориокарциноме и других опухолях. В меланоме в большом количестве синтезируется нормальный фермент тирозиназа. Из мутантных белков следует отметить протеин Ras - ГТФ-связывающий белок, участвующий в трансмембранном проведении сигнала. Маркерами рака молочной и поджелудочной желез, карцином кишечника являются модифицированные муцины (MUC 1, 2 и др.).
В большинстве случаев опухольассоциированные антигены представляют собой продукты экспрессии генов, в норме включаемых в эмбриональном периоде. Они являются слабыми иммуногенами, хотя в отдельных случаях могут индуцировать реакцию цитотоксических Т-лимфоцитов (Т-киллеров) и распознаваться в составе молекул MHC (HLA) I класса. Синтезируемые к опухольассоциированным антигенам специфические антитела не угнетают рост опухолей.
10.1.4.4. CD-антигены
На мембране клеток обнаруживаются групповые антигены, объединяющие клетки с определенными морфофункциональными характеристиками. Эти молекулы получили название антигенов кластеров дифференцировки клетки, или CD-антигенов (от англ. CellDifferentiationAntigens, или ClasterDefinition). По структуре они являются гликопротеинами и в большинстве своем относятся к суперсемейству иммуноглобулинов.
Список CD-маркеров довольно обширный и насчитывает около 200 вариантов. Среди многообразия CD-антигенов наиболее широкое распространение получили маркеры иммунокомпетентных клеток. Например, CD3 экспрессируется в популяции Т-лимфоцитов, CD4 - Т-хелперов, а CD8 - цитотоксических Т-лимфоцитов Т-киллеров, CD11a - моно- и гранулоцитов, CD11b - естественных киллеров, CD19-22 - В-лимфоцитов. Информация о структуре закодирована в различных участках генома, а экспрессия зависит от стадии дифференцировки клетки и ее функционального состояния.
CD-антигены имеют значение в диагностике иммунодефицитных состояний. Определение CD-маркеров осуществляется в иммунологических реакциях с использованием моноклональных антител.
Антигены микробов
10.1.5.1. Антигены бактерий
В структуре бактериальной клетки различают жгутиковые, соматические, капсульные и некоторые другие антигены (рис. 10.2). Жгутиковые, или Н-антигены, локализуются в их жгутиках и представляют собой эпитопы сократительного белка флагеллина. При нагревании флагеллин денатурирует и Н-антиген теряет свою специфичность. Фенол не действует на этот антиген.
Соматический, или О-антиген, связан с клеточной стенкой бактерий. Его основу составляют липополисахариды. О-антиген термостабилен и не разрушается при длительном кипячении. Однако альде