10.
Работа газа при изопроцессах.
Изохорный процесс.
V=const, dV=0 =>A=0
Изобарный процесс.
P= const A=p ∫v2v1 dV=p(v2-v1)
3) Изотермический процесс.
Выразим P из уравнения PV=НюRT
P=  RT/V
RT/V
A= ∫v2v1 pdv= ∫v1v2  RTdv/v
RTdv/v
A=  RT ∫v2v1 dv/v
RT ∫v2v1 dv/v
A=  RT(lnv2-lnv1)
RT(lnv2-lnv1)
A=  RTln v2/v1
RTln v2/v1
11.
Количество теплоты - это величина энергии теплового движения молекул, переданное от одного тела к другому.
Теплоемкость тела -это количество теплоты необходимое для нагревания тела на 1K. C=бQ/dT (Дж/K)
Молярная теплоемкость - это количество теплоты, необходимое для нагревания 1 моля вещества на 1K. Cм=бQ/VdT (Дж/мольК)
Удельная теплоемкость- это количество теплоты, необходимое для нагревания единицы массы вещества на 1К. C=бQ/mdT (Дж/кгК)
Связь молярной и удельной. См=МС
Способы передачи: Излучение, конвекция, теплопроводность.
12.
Первое начало термодинамики - количество теплоты сообщаемое системе идет на увеличение внутренней энергии системы и совершение работы над внешними телами.
бQ=dU+бA
*Отражает закон сохранения энергии для термодинамических систем.
13.
1) Изотермический процесс.
T=const, dU=0ибQ=бA. Так как dT=0 =>Cт=бQ/  dT=±∞
dT=±∞
2) изохорный процесс.
dA=0, бQ=dU
Cv=бQ/  dT=1/
dT=1/  *dU/dT
*dU/dT
dU=1/2  RdT
RdT
Cv=i/2*R
3) Изобарный процесс.
бQ=dU+PdV
Cp=бQ/  dT=dU/
dT=dU/  dT+pdV/
dT+pdV/  dT
dT
Сv=dU/  dT
dT
14.
Адиабатический процесс происходит без теплообмена с внешней средой  .
. 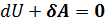 . 𝛅A=-dU
. 𝛅A=-dU
Газ совершает работу за счёт своей внут. Энергии. При адиабатическом расширении он охлаждается, при сжатии нагревается.
Уравнение Пуассона для адиабатического процесса: 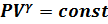 , T
, T 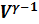 =const
=const
15.
Работа в адиабатическом процессе:



16.
Величину S= 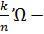 называется энтропией.
называется энтропией.
Энтропия характеризует степень молекулярного беспорядка.
Упорядоченные состояния реализуются малым числом способов-энтропия мала.
Неупорядоченные состояния реализуются большим числом способов-энтропия велика.
Вычисление Энтропии:
Отношение  -называется приведённой теплотой. В обратимом процессе:
-называется приведённой теплотой. В обратимом процессе:

17
Второе начало термодинамики
В изолированной системе энтропия не убывает
dS>=0
Она увеличивается при необратимом процессе
и остается неизменной при обратимом
18
Вычисление энтропии
Отношение  называют приведенной теплотой
называют приведенной теплотой
В обратимом процессе
dS= 

Для адиабатического процесса  S=const
S=const
это изотропный процесс
ds= 
ds=vCv  +
+ 
выразим давление из М-К:
P= 
 тут Сv
тут Сv
S2-S1= 
19
Третье начало термодинамики. теорема нернста

Следствие
1 любая теплоемкость системы при  стремится к нулю
стремится к нулю
2 аюсолютный нуль температуры недостижим
20.
Обратимый процесс -может произойти как в прямом так и в обратном направлении через те же промежутки системы. Если система вернулась в исходное состояние, ни в ней, ни в окружающей среде не возникает никаких изменений. Обратимый процесс протекает через равновероятные состояния.
К обратимым процессам относятся процессы, представляет собой непрерывную последовательность равновесных состояний. (очень медленно протекающие процессы)
Необратимые процессы - протекают только в одно направлении. Обратимые им процессы маловероятны.(Расширение газа в пустоту)
Круговые процессы или циклом называется такой процесс, по завершению которого система возвращается в исходное состояние.
В круговом процессе внутренняя энергия не изменяется.
Работа за цикл 
21.
Кпд тепловой машины.
Q1=(U2-U1)+A1
-Q2=(U1-U2)-A2
Q1-Q2=A1-A2=A
Кпд=A/Q1=(Q1-Q2)/Q1=1-Q2/Q1
Кпд холодильной машины.
Кпд=Q2/A=Q2/(Q1-Q2)
22.
Цикл Карно.
дельтаS=Q1/T1-Q2/T2=0
Q2/T2=Q1/T1
Кпд=1-Q2/Q1=1-T2/T1=(T1-T2)/T1