Одним из основных признаков ЭС клеток in vitro является их способность дифференцироваться с образованием эмбриоидых тел различной сложности, которые представляют собой зачатки всех трех зародышевых листков. Дифференцировка ЭС клеток может происходить как спонтанным путем, так и под действием некоторых химических реагентов и ростовых факторов. Известно, что активин А и трансформирующий фактор роста бетта индуцирует дифференцировку клеток мезодермального происхождения соматических мышечных и кардиомиоцитов. Другая группа факторов - ретиноевая кислота, фактор роста фибробластов и эпидермальный фактор роста - направляет дифференцировку мезодермальных и эктодермальных клеток. Наконец, фактор роста нервов и фактор роста гепатоцитов участвуют в развитии всех трех эмбриональных листков, их воздействие приводит к появлению клеток печени и поджелудочной железы, мышечных, хрящевых, кроветворных и нейрональных клеток. Интересно отметить, что при разных концентрациях ретиноевой кислоты можно добиться преимущественной дифференцировки, либо в нейрональном, либо в миогенном направлении. Исследования генетического контроля миогенной и эпителиальной дифференцировки ЭС клеток показало, что последовательность экспрессии тканеспецифических генов такая же, как и в процессе нормального развития.
Существует ряд фактов, указывающих, что некоторые клеточные прото- и онкогены принимают определенное участие в пролиферации и дифференцировке клеток. Действие ТФА, стимулирующего дифференцировку клеток нейробластомы человека, одновременно повышает активность c-src. Микроинъекция мутантного онкогена c-Ha-ras в клетки феохромоцитомы крысы PC-12 вызывает их дифференцировку и появление нейроноподобных клеток. Однако в этих работах использовались злокачественные клетки, поэтому представляет интерес исследовать возможность индуцировать дифференцировку нормальных плюрипотентных стволовых клеток путем воздействия на них клеточных прото- и онкогенов.
Одной из задач наших исследований явилось проведение сравнительного анализа действия регуляторных генов вируса иммунодефицита человека типа 1 tat и nef на пролиферацию и дифференцировку ЭС клеток мыши in vitro. Продукты генов tat и nef имеют противоположное влияние на клеточные гены. Ген tat, обладая онкогенным потенциалом, активирует транскрипцию некоторых клеточных генов и повышает пролиферацию клеток. Ген nef, подавляет экспрессию отдельных клеточных генов, и снижает рост клеток, вместе с тем кооперирует с геном tat при образовании фокусов трансформации. Для проведения этих исследований была отработана методика получения эмбриоидных тел в линии R1, При культивировании клеток RI в суспензии на 2-3-и сутки они образовывали плотные шарообразные агрегаты, называемые простыми эмбриоидными телами. При дальнейшем культивировании эмбриоидные тела увеличиваются в своих размерах и усложняются в строении. При переносе эмбриоидных тел на подложку с желатиной, они прикрепляются к субстрату, происходит миграция клеток из эмбриоидного тела по поверхности и их дифференцировка в различные клеточные типы. В результате проведенных экспериментов показано, что эффективность образования эмбриоидных тел клетками линии R1 зависит от количества клеток, высеваемых на поверхность чашки без фидерного слоя, способных образовывать эмбриоидные тела и времени культивирования эмбриоидных тел до начала дифференцировки.
Известно, что бутират натрия вызывает ряд эффектов на клетках млекопитающих в культуре, включая снижение репликации ДНК, которая приводит к остановке деления клеток, изменению морфологии клеток, изменению уровня экспрессии некоторых генных продуктов. Показано, что бутират натрия индуцирует дифференцировку клеток тератокарциномы. Нами были проведены эксперименты по спонтанной дифференцировке, а также под влиянием бутирата в клетках R1. Обнаружено появление кластеров сокращающихся клеток, предположительно кардиомиоцитов, на 2-3-и сутки, после прикрепления к подложке эмбриоидных тел. Время развития сокращающихся клеток in vitro колеблется от 2 до 10 сут. Частота пульсации этих клеток также менялась в зависимости от времени после посева эмбриоидных тел. В первые сутки частота не превышала 60 сокращений в минуту, затем она снижалась. Очевидно, способность ЭС клеток к дифференцировке in vitro является уникальной моделью для исследования процессов клеточной дифференцировки в разных типах тканей. Особенно важно, что эта клеточная система обладает способностью к направленной дифференцировке при воздействии эндогенных и экзогенных факторов. В связи с этим мы проводили исследование по изучению влияния регуляторных генов вируса иммунодефицита человека типа 1 tat и nef на пролиферацию, морфологию и дифференцировку ЭС клеток мыши. Для проведения трансфекции ЭС клеток линии R1 использовали следующие рекомбинантные плазмиды; pTat, содержащую ген tat под промотором цитомегаловируса и ген пео, устойчивость к неомицину, pNef, несущую ген nef под контролем промотора цитомегаловируса
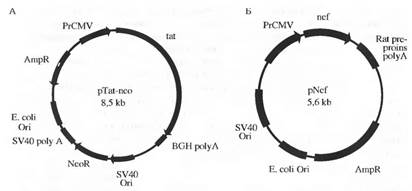
Схема плазмиды pTat. 3,1 кб Sall/PstI-фрагмент изолята НХВ-2 HIV-1, в котором делетировав ген nef, содержит 1-й транслируемый экзон гена tat, интрон и 2-й транслируемый экзон гена tat. Ген находится под управлением промотора цитомегаловируса в векторе pcDNA3. Плазмида несет также ген устойчивости к неомицину; схема плазмиды pNef. Плазмида содержит ген nef изолята HXD-3 HIV-1 под цитомегаловирусным промотором в векторе pBC12/CMv
Для выявления трансфектантов ЭС клеток в варианте с геном nef проводили котрансформацию с плазмидой pSV2neo. Параллельно клетки R] трансфицировали плазмидой pSV2neo и использовали как контрольные. В результате проведения трансфекции и селекции эмбриональных стволовых клеток мыши получены 3 линии клеток; пеок- контроль. Изменения в морфологии наблюдали только для клеток линии nef. Как видно из рис. при изучении пролиферативной активности клеток всех трех выделенных линий обнаружено, что пролиферация клеток линии tat была выше, а полиферация клеток линии nef снижалась примерно в 1,5 раза по сравнению с контрольными клетками линии пеок.
Для изучения возможного влиния генов tat и nef па дифференцировку ЭС клеток проводили эксперименты, где определяли следующие показатели для трех линий клеток: 1) время, необходимое для формирования эмбриоидного тела; 2) количество сформированных эмбриоидных тел; 3) размер эмбриоидного тела; 4) появление клеток с различной тканеспецифичностью. В результате проведенных экспериментов было показано, что время необходимое для образования эмбриоидных тел, одинаково для клеток линии пеок, tat, nef. Клетки линии пеок и nef формируют примерно одинаковое количество эмбриоидных тел - от 3 до 6 - на 3-й сутки после посева, тогда как клетки линии tat формируют в основном только одно эмбриоидное тело. Значительных различий в размерах эмбриоидных тел для этих линий не обнаружено. На 5-й день после прикрепления эмбриоидных тел клеток линии пеок к подложке появились участки сокращающихся клеток-кардиомиоцитов, что было подтверждено результатами иммуноцитохимического анализа. Количество эмбриоидных тел с сокращающимися кардиомиоцитами увеличивалось в клетках линии пеок в течение 5 дней. В клетках линии не кардиомиоциты появились только на 10-й день после прикрепления эмбриоидных тел к подложке, их количество заметно не увеличивалось в период проведения эксперимента. В эмбриоидных телах, сформированных клетками линии tat не было обнаружено появление кардиомиоцитов в течение 10 дней наблюдения. Результаты представленных экспериментов позволяют сказать, что под влиянием гена tat наблюдается тенденция повышения пролиферативной активности ЭС клеток мыши и ее подавление под влиянием гена nef, что согласуется с данными, полученными на клетках крысы двух линий: псевдонормальных клетках Rat-2 и клетках феохромоцитомы PC-12. Полученные данные также позволяют предположить, что регуляторные гены ВИЧ-1 tat и nef могут оказывать влияние как на ранние стадии дифференцировки ЭС клеток, так и на процесс дифференцировки этих клеток в кардиомиоциты.
Разработка методов направленной тканеспецифической дифференцировки, помимо теоретического значения для изучения молекулярных механизмов клеточной дифференцировки, имеет и прикладное значение, такие клетки в перспективе могут быть использованы в клеточной терапии и трансплантации у человека.
Для изучения путей дифференцировки ЭС клеток в разные типы клеток in vivo используются подходы по пересадке таких клеток в различные органы взрослых животных с последующей регистрацией судьбы этих клеток. Для объективного обнаружения пересаженных клеток необходимо иметь "маркированные" линии ЭС клеток. Нами были получены линии ЭСК, трансфицированные геном "зеленого белка". Такие клетки легко детектируются на срезах органов и тканей с помощью флуоресцентной микроскопии. На рис. ПО показаны ЭС клетки линии R1, трансфицированные плазмидой, содержащей ген "зеленого белка".
Проведенные нами совместно с Институтом биологии гена РАН и Институтом биологии развития РАН по пересадке "зеленых клеток" в различные отделы мозга крысы, показали, что такие клетки могут сохранять жизнеспособность в чужеродном организме не менее одной недели.