МЕТОД КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Сущность метода
К методу кислотно-основного титрования (нейтрализация) относят все определения, в основе которых лежит реакция
Н+ + ОН− → Н2О
По этому методу можно, пользуясь титрованным раствором какой-либо кислоты, проводить количественное определение щелочей (ацидиметрия) или, пользуясь титрованным раствором щелочи, количественно определять кислоты (алкалиметрия).
При помощи этого метода проводят ряд других определений, например определение некоторых солей, имеющих, подобно Nа2СО3 и Nа2В4О7, сильнощелочную реакцию вследствие гидролиза и потому титрующихся кислотами, определение жесткости воды, определение солей аммония, определение азота в органических соединениях и т. д.
Основными рабочими растворами в этом методе являются раствор кислоты (обычно НС1 или H2SO4) и раствор щелочи (обычно NаОН или КОН).
Эти вещества не отвечают требованиям, которые предъявляются к стандартным веществам, и потому титрованные растворы их нельзя приготовлять, исходя из точной навески вещества, раствор которой разбавляют до определенного объема; концентрацию таких растворов приходится устанавливать путем титрования (или весовым путем).
В качестве стандартных веществ при установке титров кислот чаще всего применяют:
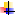 тетраборат натрия (буру) Nа2В4О7∙10Н2О или
тетраборат натрия (буру) Nа2В4О7∙10Н2О или
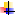 безводный карбонат натрия (соду).
безводный карбонат натрия (соду).
Эти вещества могут быть получены практически свободными от примесей, строго отвечающими своим формулам. Растворы их, как было указано, обладают сильнощелочной реакцией и могут титроваться кислотами.
Для установки титра щелочей чаще всего пользуются
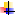 щавелевой кислотой Н2С2О4∙2Н2О или
щавелевой кислотой Н2С2О4∙2Н2О или
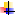 янтарной кислотой Н2С4Н4О4.
янтарной кислотой Н2С4Н4О4.
Обе эти кислоты - твердые кристаллические вещества. После перекристаллизации они также получаются достаточно чистыми, строго соответствующими своим формулам. Янтарная кислота в качестве стандартного вещества удобнее щавелевой, так как она не содержит кристаллизационной воды, и нет основания опасаться ее выветривания при хранении.
Известно, что всякий водный раствор, независимо от его реакции, вследствие ионизации воды содержит Н+- и ОН−- ионы. Произведение концентраций указанных ионов при постоянной температуре сохраняет (приблизительно) постоянное значение. При 25°С во всяком водном растворе ионное произведение воды равно:
[H+][OH−]=KH2O=10-14 (1)
Согласно теории электролитической диссоциации кислотные свойства растворов зависят от Н+-ионов, а основные - от ОН−-ионов.
В воде, а также во всех нейтральных водных растворах концентрации Н+-ионов должны быть равны между собой. Следовательно, при 25 °С эти концентрации равняются
[Н+]=[ОН−]=  г-ион/л
г-ион/л
В кислых растворах:
[Н+]>[ОН−], т.е. [Н+]>10-7 и [ОН−]<10-7
В щелочных растворах:
[ОН−]>[Н+], т.е. [ОН−]>10-7 и [Н+]<10-7
Обратно пропорциональная зависимость между концентрациями Н+ и ОН−-ионов, выражаемая уравнением (1), позволяет реакцию любого раствора охарактеризовать количественно, указав концентрацию в нем только одного из этих ионов, так как тем самым будет вполне определена также и концентрация другого иона. Например, если концентрация Н+ в растворе равна 10-10 г-ион/л,то концентрация ОН− в нем равняется
10-14:10-10=10-4
и раствор имеет щелочную реакцию.
Вместо величин концентраций Н+- или ОН−-ионов для характеристики реакции растворов удобнее пользоваться их отрицательными логарифмами, называемыми водородным и гидроксильным показателями - рН и рОН. Таким образом
pH = -lg[H+] и рОН = - lg [ОН−]
Если прологарифмировать уравнение (1) и переменить знаки логарифмов на обратные, то получим:
(-lg[H+]) + (-lg[ОН−])=14
или
рН + рОН = 14 (2)
Связь между концентрациями Н+- и ОН−-ионов, величинами рН и рОН растворов и их реакцией наглядно показана в таблице ниже.
Из табл. следует, что:
 в нейтральных растворах рН, а также рОН равны 7;
в нейтральных растворах рН, а также рОН равны 7;
 в кислых растворах рН меньше 7 и тем меньше, чем раствор более кислый;
в кислых растворах рН меньше 7 и тем меньше, чем раствор более кислый;
 в щелочных растворах рН больше 7 и тем больше, чем раствор более щелочной;
в щелочных растворах рН больше 7 и тем больше, чем раствор более щелочной;
 возрастание рН на одну единицу соответствует уменьшению концентрации Н+- ионов в 10 раз.
возрастание рН на одну единицу соответствует уменьшению концентрации Н+- ионов в 10 раз.
Таблица. Связь между величинами [Н+], [ОН−],рН, рОН иреакцией раствора
| [H+] | [ОН−] | pH | pOH | Реакция |
| 10-14 | Кислая | |||
| 10-1 | 10-13 | |||
| 10-2 | 10-12 | |||
| 10-3 | 10-11 | |||
| 10-4 | 10-10 | |||
| 10-5 | 10-9 | |||
| 10-6 | 10-8 | |||
| 10-7 | 10-7 | Нейтральная | ||
| 10-8 | 10-6 | Щелочная | ||
| 10-9 | 10-5 | |||
| 10-10 | 10-4 | |||
| 10-11 | 10-3 | |||
| 10-12 | 10-2 | |||
| 10-13 | 10-1 | |||
| 10-14 |
Если титровать раствор любой кислоты раствором щелочи, то ОН − -ионы щелочи связывают Н+-ионы кислоты и концентрация их постепенно уменьшается, а рН раствора возрастает. При каком-то определенном значении рН достигается точка эквивалентности и прибавление щелочи должно быть прекращено.
При титровании раствора щелочи раствором кислоты ОН − -ионы связываются Н+-ионами и концентрация их в растворе постепенно увеличивается, а рН раствора уменьшается. При некотором определенном значении рН достигается точка эквивалентности и титрование в этот момент должно быть закончено.
Величина рН в точке эквивалентности зависит от природы реагирующих веществ (кислоты и основания) и от их концентраций.
Например, титрование сильной кислоты (НС1) сильным основанием (NaOH) протекает по схеме
Н+ + ОН − ↔ Н2О
В этом случае по достижении точки эквивалентности количество прибавленного сильного основания будет эквивалентно количеству титруемой кислоты, т. е. в этот момент в растворе будет только образовавшаяся при реакции соль (NaCl) без всякого избытка кислоты или щелочи, Соли сильных кислот и сильных оснований не подвергаются гидролизу, и потому их растворы имеют нейтральную реакцию (рН = 7).
Следовательно, и в точке эквивалентности в рассматриваемом случае рН должен равняться 7. То же будет, очевидно, и при титровании любой другой сильной кислоты какой-либо щелочью, а также при титровании щелочи сильной кислотой.
Однако если сильную кислоту заменить слабой, например уксусной кислотой, то при титровании будет происходить следующая реакция:
СН3СООН + ОН − ↔ СН3СОО − + Н2O
В точке эквивалентности в растворе будет присутствовать соль CH3COONa, гидролиз которой протекает по схеме
СН3СОО − + Н2О ↔ СН3СООН + ОН −
Как видно, гидролиз представляет собой реакцию, обратную нейтрализации. Протекающая при титровании реакция в этом случае окажется обратимой и не будет доходить до конца. Часть кислоты и щелочи останется в растворе в свободном состоянии. В точке эквивалентности количества свободных СН3СООН и NaOH будут, конечно, эквивалентны друг другу. Но в то время как уксусная кислота, присутствующая главным образом в виде неионизированных молекул СНзСООН, будет отдавать в раствор очень мало Н+-ионов, едкий натр, диссоциированный почти полностью, создаст гораздо большую концентрацию ОН − -ионов в растворе.
Следовательно, заканчивать титрование нужно уже не при рН 7, как в случае титрования НС1, а при рН > 7.
Точно так же найдем, что при титровании слабых оснований сильными кислотами, например
NН4ОН + Н+ ↔ NH4+ + Н2О
в точке эквивалентности реакция раствора определяется гидролизом NH4+приводящим к накоплению Н+-ионов.
Следовательно, в этом случае рН в точке эквивалентности должен быть меньше 7.
Подводя итоги сказанному, видим, что в разных случаях, титрование приходится заканчивать при различных значениях рН, зависящих от природы реагирующих между собой кислоты и основания (а также от их концентраций).
Индикаторы в методе кислотно-основного титрования
Как известно, реакция нейтрализации не сопровождается видимыми изменениями, например переменой окраски раствора. Поэтому для фиксирования точки эквивалентности приходится прибавлять к титруемому раствору какой-либо подходящий индикатор.
Выше указывалось, что признаком достижения точки эквивалентности служит приобретение раствором определенного значения рН. Индикаторами в методе кислотно-основного титрования служат вещества, окраска которых меняется в зависимости от изменения величины рН. Поэтому эти вещества называют кислотно-основными индикаторами. Окраска каждого из индикаторов изменяется внутри определенного узкого интервала значений рН, причем этот интервал зависит только от свойств данного рН-индикатора и совершенно не зависит от природы реагирующих между собой кислоты и основания.
К индикаторам предъявляются следующие требования:
 окраска индикатора при близких значениях рН должна явно отличаться;
окраска индикатора при близких значениях рН должна явно отличаться;
 изменение цвета индикатора должно происходить резко в небольшом интервале значений рН;
изменение цвета индикатора должно происходить резко в небольшом интервале значений рН;
 окраска индикатора должна быть возможно более интенсивной;
окраска индикатора должна быть возможно более интенсивной;
 количество щелочи или кислоты, необходимое для изменения окраски индикатора, должно быть настолько мало, чтобы не искажались результаты титрования;
количество щелочи или кислоты, необходимое для изменения окраски индикатора, должно быть настолько мало, чтобы не искажались результаты титрования;
 изменение окраски индикатора должно быть вполне обратимым процессом.
изменение окраски индикатора должно быть вполне обратимым процессом.
Все эти требования сильно ограничивают выбор индикаторов. Несмотря на большое число известных веществ, обладающих индикаторными свойствами, число широко применяемых индикаторов не превышает двадцати. Очень большое значение имеет правильный выбор индикатора при титровании.
Теория индикаторов
Значение индикаторов для титриметрического анализа было оценено химиками давно. Однако вплоть до конца прошлого столетия исследования индикаторов носили чисто эмпирический характер и не затрагивали сущности тех физико-химических процессов, которые происходят при изменении окраски индикаторов. Причиной этого являлось отсутствие общей химической теории, которая могла бы послужить основой для разработки учения об индикаторах и позволила бы рассматривать все многообразие полученного экспериментального материала с одной общей точки зрения.
Такой теорией оказалась появившаяся в 1887 г. теория электролитической диссоциации С. Аррениуса, и уже через 7 лет после ее появления (в 1894 г.) Оствальдом была создана так называемая иoнная теория индикаторов.
Согласно этой теории, индикаторы в методе кислотно-основного титрования представляют собой такие слабые органические кислоты или основания, у которых неионизированные молекулы и ионы имеют различную окраску.
Например, по этой теории лакмус содержит особую (азолитминовую) кислоту, неионизированные молекулы которой красного, а анионы - синего цвета. Условимся всякую индикаторную кислоту обозначать схематически через Hind, а анионы ее - через Ind−. Тогда ионизацию лакмуса можно представить следующим уравнением:
HInd ↔ H+ + Ind−
Красные синие
При растворении лакмуса в воде неионизированные молекулы его, присутствуя совместно с ионами, придают раствору промежуточную, т. е. фиолетовую окраску. Если к этому фиолетовому раствору лакмуса прибавить каплю кислоты, например HCl, то приведенное выше равновесие сместится влево. Другими словами, введенные Н+-ионы_свяжут большую часть имевшихся в растворе анионов Ind− в неионизированные молекулы Hind, и раствор покраснеет.
Наоборот, если к раствору лакмуса прибавить щелочь, то ее ОН− ионы будут связывать Н+-ионы индикатора в неионизированные молекулы Н2О. В результате этого равновесие ионизации индикатора сместится вправо, т. е. в сторону накопления в растворе анионов Ind−, и раствор посинеет.
У лакмуса обе формул его (т. е. молекулы Hind и ионы Ind−) окрашены. Такие индикаторы называются двуцветными. Существуют также одноцветные индикаторы, у которых окрашена только одна из форм, другая же бесцветна. К ним относится, например, фенолфталеин, в кислых растворах бесцветный, а в щелочных - имеющий красную окраску. Учитывая, что этот индикатор представляет собой слабую кислоту и что неионизированные молекулы его должны накапливаться в кислом, а анионы в щелочном растворах, можно на основании рассматриваемой теории, процесс ионизации фенолфталеина представить так:
HInd ↔ H+ + Ind−
Бесцветные красные
По аналогии можно объяснить с точки зрения ионной теории индикаторов и перемену окраски основных индикаторов. Если неионизированные молекулы подобного индикатора обозначить через IndOH, а катионы - через Ind+, то ионизация индикатора в растворах изображается схемой:
IndOH ↔ Ind+ + OH−
Добавляя к раствору щелочь, равновесие ионизации индикатора смещают влево, и раствор приобретает окраску неионизированных молекул IndOH. При подкислении (т. е. связывании ОН−-ионов) оно смещается вправо, и раствор приобретает окраску катионов Ind+.
Следовательно, ионная теория индикаторов очень просто и наглядно объясняет причину изменения окраски индикаторов под влиянием введения в раствор Н+ или ОН−. Важным преимуществом ее является также то обстоятельство, что она допускает количественную интерпретацию. Однако она не объясняет всех свойств индикаторов. Например, оказалось, что окраска органических соединений зависит от строения их молекул и что, следовательно, измениться она может только в результате какой-либо внутримолекулярной перегруппировки, изменяющей строение индикаторов. В результате ряда исследований возникла другая, так называемая хромофорная теория индикаторов.
Свое название эта теория получила потому, что окраска органических соединений приписывается наличию в молекулах особых атомных групп (обычно содержащих двойные связи), называемых хромофорами.
К хромофорам относятся
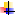 нитрогруппа O=Ná, способная превращаться в группу НО-N£, и
нитрогруппа O=Ná, способная превращаться в группу НО-N£, и
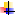 азогруппа -N=N-, переходящая при известных условиях в группу =N-NH-.
азогруппа -N=N-, переходящая при известных условиях в группу =N-NH-.
Очень важным хромофором являются соединения с хиноидной структурой. Образование этой структуры из бензольной протекает по схеме:

бензольная хиноидная
и, согласно хромофорной теории, очень часто оказывается причиной перемены окраски индикаторов. Кроме перечисленных выше групп к хромофорам принадлежат и несколько близко расположенных друг к другу карбонильных групп >С=О или двойных связей и т. п.
На окраску органических соединений влияет также присутствие другого рода групп, называемых ауксохромами. В отличие от хромофоров ауксохромы сами по себе не способны сообщать окраску соединению, но, присутствуя совместно с хромофорами, они усиливают их действие, углубляя вызванную ими интенсивность окраски.
Важнейшими ауксохромами являются группы -ОН и -NH2, а также их производные, содержащие различные радикалы, например группы –ОСН3, -N(CH3)2, -N(C2H5)2 и т. д.
Изменение окраски индикаторов является, согласно хромофорной теории, следствием изомерного превращения, т. е. внутримолекулярной перегруппировки, изменяющей строение индикатора.
Если при этой перегруппировке возникают (или исчезают) группы (хромофоры, ауксохромы), влияющие на окраску, то она изменяется. Следует заметить, что превращение изомерных форм индикаторов представляет собой процесс обратимый. Такая обратимая изомерия называется таутомерией, а соответствующие изомеры - таутомерами. Согласно хромофорной теории в растворе любого кислотно-основного индикатора присутствуют различные таутомерные формы его, обладающие различной окраской и находящиеся в равновесии друг с другом.
Иллюстрируем рассматриваемую теорию на примере индикатора паранитрофенола, строение которого значительно проще, чем строение других обычно применяемых индикаторов. В этом случае происходит следующее таутомерное превращение:

бесцветный желтый
Как видно из приведенной схемы, сущность этого превращения заключается в том, что бензольная структура индикатора переходит вхиноидную. Именно образование хиноидной структуры и является причиной изменения окраски паранитрофенола при подщелачивании раствора. При его подкислении равновесие между обоими таутомерами смещается в противоположном направлении и желтый раствор индикатора обесцвечивается.