Точка эквивалентности может находиться в нейтральной, кислой или щелочной средах в зависимости от природы титруемых веществ. Для того чтобы правильно выбрать индикатор, нужно знать, как изменяется рН в процессе титрования, вблизи точки эквивалентности, какое значение рН имеет раствор в точке эквивалентности. Чтобы ответить на все эти вопросы прибегают к расчету и построению кривых титрования. Кривые титрования в методе кислотно-основного титрования являются графическим изображением изменения рН раствора при постепенном прибавлении рабочего раствора к определенному количеству исследуемого раствора. Для упрощения вычислений (что не приводит к заметным ошибкам) обычно не учитывают разбавления раствора в процессе его титрования.
Остановимся на методе построения кривых титрования. Положим, например, что 100 мл 0,1 н. раствора НС1 титруют 0,1 н. раствором NaOH. Вычислим величины рН раствора в различные моменты титрования. При вычислении рН раствора сильных кислот или оснований (поскольку по современным представлениям они ионизированы в растворах практически полностью) концентрацию ионов Н+ (или ОН-) можно приравнять к общей_концентрации кислоты (или основания).
Для упрощения вычислений, как сказано выше, будем считать, что общий объем раствора при титровании не меняется. В действительности этот объем к концу титрования увеличивается вдвое. Очевидно, ошибка в вычислении величины рН без учета увеличения объема равна lg2, т. е. приблизительно 0,3. Такая ошибка в данном случае на выводах не отразится, и потому с нею можно не считаться.
До начала титрования имеется 0,1 н. раствор НСl, рН которого равен 1. Положим теперь, что_к 100 мл0,1 н. раствора НСl прибавлено 90 мл 0,1 н. раствора NaOH. При этом 0,9 (т. е. 90%) всего количества кислоты будет нейтрализовано. Свободной кислоты останется в 10 раз меньше, чем ее было до начала титрования. А так как изменениями объема пренебрегают, то можно считать, что концентрация свободной кислоты (Скисл.) станет в 10 раз меньше, чем была вначале, т. е. будет равна 0,01 моль/л.Следовательно, рН раствора в этот момент будет приблизительно равен 2.
Если же учесть изменения объема, то 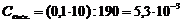 , откуда
, откуда 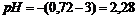
Когда к титруемому раствору прибавляют 99 млNaOH, концентрация свободной НСl уменьшается еще в 10 раз, т. е. до 0,001 моль/л,арН раствора возрастает приблизительно до 3. Так же найдем, что при добавлении 99,9 млNaOH Скисл понизится до 0,0001 моль/л,а рН возрастает приблизительно до 4.
Когда к 100 млвзятой для титрования НСl прибавляют ровно 100 млраствора NaOH той же нормальности, то в раствор вводят как раз эквивалентное имевшейся кислоте количество щелочи, т. е. достигают точки эквивалентности. В этот момент раствор будет содержать только образующуюся при реакции соль NaCl. Поскольку же последняя не подвергается гидролизу, рН раствора будет равен 7. Именно в этот момент следует заканчивать титрование. Однако для того, чтобы получить представление о ходе изменения рН в тех случаях, когда титруют щелочь кислотой, продолжим вычисление вплоть до 100%-ного избытка NaOH.
Положим, что добавлено щелочи на 0,1 млбольше, чем нужно, т. е. 100,1 мл.Поскольку концентрация NaOH такова же, как у НСl, это избыточное количество (0,1 мл)щелочи должно создать такую же концентрацию ОН--ионов в растворе, какую концентрацию H+-ионов создавал избыток НСl, равный 0,1 мл.
Следовательно, [ОН-] в этот момент будет равна приблизительно 10-4, [Н+]=10-10 и рН 10.
Так же найдем, что при затрате 1 млизбытка щелочи [ОН-]=10-3, [Н+]=10-11 и рН 11 и т. д.
Полученные результаты сопоставлены в табл.,
Таблица. Изменение рН при титровании 100 мл 0,1 н. раствора НСl 0,1 н. раствором NaOH (или наоборот)
| Прибавлено NaOH, мл | Скисл., моль/л | Сщел., моль/л | [H+] | [OH-] | pH |
| 0,1 | - | 10-1 | 10-13 | ||
| 0,01 | - | 10-2 | 10-12 | ||
| 0,001 | - | 10-3 | 10-11 | ||
| 99,9 | 0,0001 | - | 10-4 | 10-10 | |
| - | - | 10-7 | 10-7 | ||
| 100,1 | - | 0,0001 | 10-10 | 10-4 | |
| 101,0 | - | 0,001 | 10-11 | 10-3 | |
| - | 0,01 | 10-12 | 10-2 | ||
| - | 0,1 | 10-13 | 10-1 |
а также представлены в виде кривой титрования, изображенной на рис.
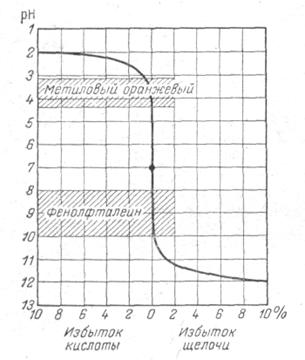
При построении кривых титрования на оси абсцисс откладывают имеющийся в разные моменты титрования избыток кислоты или щелочи в растворе (в процентах), а на оси ординат - соответствующие им величины рН раствора. Ход кривой слева направо характеризует изменение рН при титровании кислоты щелочью. Наоборот, справа налево - соответствует изменению рН при титровании щелочи кислотой. Для уменьшения размеров рисунка избыток кислоты и щелочи ограничен 10%.
Рассматривая кривую титрования 0,1 н. раствора солянойкислоты 0,1 н. раствором едкого натра, прежде всего замечаем, что точка эквивалентности (отмеченная на кривой черной точкой) совпадает в данном случае с точкой нейтрализации (рН 7).
Далее обращает на себя внимание чрезвычайно резкий скачок рН вблизи конца титрования. В самом деле, в то время как при прибавлении почти всей (99,9 мл)щелочи рН изменяется всего на 3 единицы (от 1 до 4), переход от 0,1 млизбытка кислоты к 0,1 млизбытка щелочи (т. е. 99,9 млдо 100,1 мл прибавленного NaOH) влечет за собой изменение рН на целых 6 единиц (от 4 до 10). Если же, как это обычно бывает на практике, титруют не 100 млраствора, а 25 мл, те указанное изменение рН, отвечающее понижению концентрации Н+-ионов в миллион раз; происходит от прибавления не 0,2 мл,а 0,2:4 - 0,05 млраствора NaОH. Это количество его соответствует всего 1-2 каплям раствора.
На первый взгляд может показаться, что должен быть употреблен обязательно такой индикатор, окраска которого меняется при рН 7, т. е. как раз в точке эквивалентности данного титрования, например, лакмус или бромтимоловый синий, показатели титрования которых около 7.
Однако если учесть отмеченный выше скачок рН на кривой титрования, то станет ясно, что с таким же успехом можно было бы применить, например, метиловый оранжевый, хотя с ним титрование заканчивают не при рН 7, а при рН 4, или фенолфталеин, так как при прибавлении 0,1 млизбытка 0,1 н. раствора NaOH, рН раствора будет 10.
Из всего этого нетрудно вывести основное правило выбора индикатора:
|