Принцип Ле Шателье
Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрации реагирующих веществ), то равновесие смещается в сторону той реакции, которая ослабляет указанное воздействие.
Рассмотрим применение принципа Ле Шателье к решению конкретных задач.
Задача 1. Какими изменениями температуры, давления, концентраций участвующих в реакции веществ можно сместить влево равновесие системы
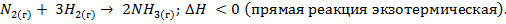
Решение. Процесс 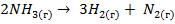 идет:
идет:
1) с понижением температуры (так как прямая реакция – экзотермическая, идет с повышением температуры);
2) с повышением давления (так как в результате реакции число молей газообразных веществ возрастает, согласно уравнению реакции, от двух (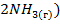 до четырех
до четырех 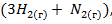 и давление в закрытом сосуде при этом также возрастет);
и давление в закрытом сосуде при этом также возрастет);
3) с понижением концентрации аммиака (так как 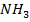 является исходным веществом и расходуется в процессе реакции); с повышением концентраций водорода и азота (так как
является исходным веществом и расходуется в процессе реакции); с повышением концентраций водорода и азота (так как 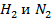 – продукты, содержание которых в процессе реакции накапливается).
– продукты, содержание которых в процессе реакции накапливается).
Чтобы сместить равновесие влево, то есть ускорить рассмотренную реакцию, нужно:
1) повысить температуру;
2) понизить давление;
3) повысить концентрацию аммиака и понизить концентрации водорода и азота.
Задача 2. Какими изменениями температуры, давления, концентраций веществ можно сместить вправо равновесие системы
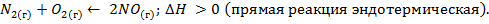
Решение. Процесс 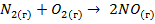 идет:
идет:
1) с понижением температуры (так как прямая реакция – эндотермическая, идет с понижением температуры);
2) без изменения давления (так как в результате реакции число молей газообразных веществ не изменяется);
3) с понижением концентраций исходных веществ азота и кислорода и повышением концентрации продукта реакции оксида азота (II).
Чтобы сместить равновесие вправо, в сторону рассмотренного процесса, нужно:
1) повысить температуру;
2) изменение давления не влияет на смещение равновесия;
3) повысить концентрации азота и кислорода, понизить концентрацию оксида азота (II).
Задача 3. Как отразится повышение температуры на равновесии системы
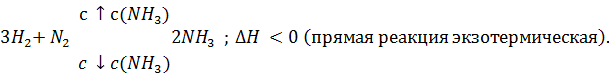
Решение. При повышении температуры равновесие сместится в сторону понижения температуры, в сторону обратной реакции.
Выводы. При повышении температуры равновесие смещается в сторону эндотермической реакции.
При понижении температуры равновесие смещается в сторону экзотермической реакции.
Задача 4. Как отразится повышение давления на равновесии системы
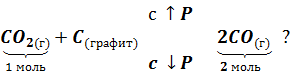
| Графит C |
|
|
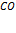
|
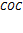 О О
|
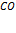
|
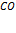
|
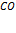
|
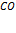
|
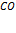
|
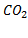
|
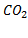
|
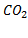
|
¡ При решении задач, связанных с изменением давления, рассматривают молекулы только газообразных веществ
Решение. При повышении давления равновесие сместится в сторону понижения давления, в сторону обратной реакции.
Выводы. При увеличении давления путем сжатия системы равновесие сдвигается в сторону понижения давления, то есть в сторону уменьшения числа молекул газообразных веществ.
При уменьшении давления равновесие сдвигается в сторону увеличения числа молекул газообразных веществ.
Задача 5. Куда сместится равновесие системы
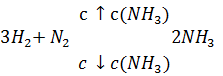
при понижении концентрации аммиака?
Решение. При понижении концентрации аммиака равновесие сместится в сторону повышения концентрации аммиака, в сторону прямой реакции.
Выводы. При повышении концентрации исходного вещества равновесие смещается в сторону продуктов химической реакции.
При повышении концентрации продуктов реакции равновесие смещается в сторону исходных веществ.