Тема 4: Оптические и молекулярно-кинетические свойства дисперсных систем.
1 Оптические свойства.
2 Молекулярно-кинетические свойства.
3 Осмотическое давление.
4 Седиментация.
(Рассказать):
В производственной практике при использовании измельченных веществ существует оптимальная степень их раздробленности, которая определяется требованиями технологии. От размера частиц дисперсной фазы, а в случае полидисперсных систем и от относительного содержания в системе фракций определенного усредненного размера (фракционный или гранулометрический состав) зависят многие физические и химические свойства дисперсных систем. Например, от тонкости помола цементного клинкера зависит химическая активность цемента по отношению к воде. Фракционный состав глинистых буровых растворов определяет их физические свойства: пластичность, набухаемость, сжимаемость, водопроницаемость, сопротивление сдвигу и т.д. Изменение многих свойств в зависимости от степени дисперсности объясняется в основном тем, что изменение степени дисперсности дисперсных систем приводит к изменению поверхностной энергии. С целью установления размера дисперсных частиц или фракционного состава дисперсную систему подвергают дисперсионному анализу.
Простейшим методом дисперсионного анализа, является ситовой анализ, который заключается в просеивании исследуемого образца через набор сит с определенными размерами отверстий. Этот метод используют для грубодисперсных систем с размерами частиц более 200 мм. Методы дисперсионного анализа более высокодисперсных систем основываются на их оптических и молекулярно-кинетических свойствах.
Оптические свойства
При пропускании света через дисперсную систему он может отражаться или рассеиваться частицами. Это зависит от соотношения длины волны и размеров частиц, на которые падает световой поток.
В грубодисперсных системах размер частиц больше длины волн видимого света (760-400 нм). Поэтому световые лучи не могут обойти эти частицы, отражаются от их поверхности и преломляются на границе раздела частиц со средой. Отражение света проявляется в мутности таких систем.
Если размеры частиц меньше половины длины волны света, то волны света, встречаясь с такими мелкими частицами, огибают их и рассеивают во всех направлениях. Следовательно, в истинных и коллоидных растворах видимый свет рассеивается, а в проходящем свете эти растворы прозрачны. В истинных растворах низкомолекулярных веществ светорассеивание ничтожно, так как растворенное вещество раздроблено до небольших молекул или ионов и нет препятствий для прохождения лучей видимого света. В коллоидных растворах рассеивание достигает наибольшей интенсивности. Коллоидная частица, рассеивая свет, сама при этом как бы становится источником света. Это свечение называется опалесценцией. При освещении коллоидного раствора ярким световым пучком путь его виден при наблюдении сбоку в виде светового конуса (рис. 1). Этот эффект был впервые исследован Д. Тиндалем и назван его именем. Им пользуются для отличия коллоидных растворов от истинных.

Рис. 1. Рассеивание света истинным раствором (I) и коллоидным раствором (2).
Интенсивность рассеянного света определяется уравнением Дж.Рэлея:
 , (1)
, (1)
где  -интенсивность падающего света; К - постоянная, зависящая от разности между показателями преломления дисперсной фазы и дисперсной среды; V- объем частицы;
-интенсивность падающего света; К - постоянная, зависящая от разности между показателями преломления дисперсной фазы и дисперсной среды; V- объем частицы;
С - число частиц в единице объема (частичная концентрация),  - длина волны падающего света.
- длина волны падающего света.
Из уравнения следует, что интенсивность светорассеивания усиливается при увеличении концентрации частиц и их размера (но с диаметром не более 40-70 мм), коротковолновом облучении и при значительном отличии показателей преломления дисперсной фазы и дисперсной среды. На явлении рассеивания света коллоидными частицами основаны методы их исследования: ультрамикроскопия и нефелометрия, с помощью которых определяют размеры, форму и концентрацию частиц дисперсной фазы в коллоидно-дисперсных системах.
Молекулярно-кинетические свойства
Гетерогенные дисперсные системы по своим молекулярно-кинетическим свойствам принципиально не отличаются от истинных растворов, только эти свойства у них выражены значительно слабее. Молекулярно-кинетические свойства гетерогенных дисперсных систем связаны с движением частиц дисперсной фазы. К этим свойствам относятся броуновское движение, диффузия, осмотическое давление, седиментация. Броуновское движение выражается в том, что частицы дисперсной фазы коллоидно- и грубодисперсных систем под влиянием ударов молекул дисперсной среды находятся в состоянии беспорядочного, видимого (в микроскоп) движения. Интенсивность движения возрастает с уменьшением размера частиц и вязкости среды, а также с повышением температуры.
Броуновское движение является причиной диффузии частиц в дисперсных системах. Коллоидные частицы диффундируют в дисперсной среде, стремясь равномерно распределиться по всему объему системы. Скорость диффузии измеряется коэффициентом диффузии, который характеризует количество вещества, переносимого через площадь 1 см в единицу времени. Размерность его см2*с-1 или см2*сут-1. Коэффициент диффузии для сферических частиц, значительно больших по размеру, чем молекулы дисперсионной среды, выражается уравнением
 , (2)
, (2)
где NA - число Авогадро;  - коэффициент вязкости дисперсионной среды; r -радиус частиц дисперсной фазы.
- коэффициент вязкости дисперсионной среды; r -радиус частиц дисперсной фазы.
Чем крупнее частицы и чем соответственно меньше скорость их движения, тем меньше скорость их движения, тем меньше и скорость их диффузии. Поэтому коэффициенты диффузии в коллоидных растворах чрезвычайно малы. На основании измерений коэффициента диффузии можно определить и размер коллоидных частиц.
Осмотическое давление
Так как коллоидные частицы по величине и массе в огромное число раз превосходят молекулы низкомолекулярных веществ, то при одной и той же массе дисперсной фазы в единице объема коллоидного раствора содержится значительно меньше частиц, чем в единице объема истинного раствора. Поэтому осмотическое давление коллоидных растворов много меньше, чем осмотическое давление истинных растворов. Довольно часто с увеличением концентрации золя осмотическое давление не увеличивается, как у истинных растворов, а наоборот уменьшается. Это связано с укрупнением (агрегированием) коллоидных частиц при увеличении концентрации. Закон Вант-Гоффа справедлив и для золей, но для них он записывается через частичную концентрацию ν (число частиц в единице объема, ν=С*NA.)
 , (3)
, (3)
Число частиц в единице объема при данной весовой концентрации вещества прямо пропорционально степени дисперсности и обратно пропорционально кубу линейных размеров частиц. Поэтому осмотическое давление различных золей обратно пропорционально массам частиц золей или их радиусам в третьей степени. Такая зависимость используется для определения размеров частиц и исследования их агрегирования в дисперсных системах.
Седиментация
Частицы, диспергированные в жидкой или газообразной среде, испытывают воздействие двух противоположно направленных сил. Сила тяжести заставляет частицы оседать (седиментировать), а силы диффузии распределить их равномерно по всему объему системы.
В зависимости от преобладания тех или иных сил в системе наблюдается осаждение частиц дисперсной фазы или выравнивание концентрации во всем объеме. Процесс оседания частиц под действием силы тяжести называется седиментацией. Скорость седиментации описывается уравнением:
 , (4)
, (4)
где r - радиус частиц;  и
и  плотности вещества частиц дисперсной фазы и дисперсионной среды;
плотности вещества частиц дисперсной фазы и дисперсионной среды;  - вязкость среды; g -ускорение силы тяжести. Из уравнения видно, что скорость оседания особенно зависит от размера частиц.
- вязкость среды; g -ускорение силы тяжести. Из уравнения видно, что скорость оседания особенно зависит от размера частиц.
Относительно размера частиц уравнение приобретает вид:
 , (5)
, (5)
Если в системе силы тяжести уравновешены силами диффузии, наступает так называемое седиментационное равновесие, которое характеризуется равенством скоростей седиментации и диффузии (рис. 2). При этом устанавливается определенное распределение частиц по высоте и объему. Способность дисперсных систем сохранять такое состояние во времени называется седиментационной или кинетической устойчивостью. Истинные растворы обладают очень высокой кинетической устойчивостью.
Грубодисперсные системы кинетически неустойчивы, их частицы оседают под действием силы тяжести. Кинетическая устойчивость коллоидных растворов определяется размером частиц: чем меньше их размер, тем более устойчив раствор.
Седиментационное равновесие полидисперсных систем характеризуется уменьшением концентрации частиц в направлении от нижних слоев к верхним. Такое распределение частиц по высоте описывается уравнением Лапласа
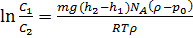 , (6)
, (6)
где С1 и С2 - концентрации частиц соответственно на высоте h1 и h2; m- масса одной частицы;  и
и  - плотности частиц и дисперсионной среды; NA-постоянная Авогадро; g -ускорение силы тяжести.
- плотности частиц и дисперсионной среды; NA-постоянная Авогадро; g -ускорение силы тяжести.
В зависимости от соотношения плотностей частиц и среды более крупные частицы оказываются в нижней части сосуда (при  >
>  ) или концентрируются в верхних слоях
) или концентрируются в верхних слоях
(при  <
<  ).
).
Определив экспериментально скорость седиментации частиц за определенные промежутки времени по формуле (4) можно рассчитать усредненный радиус частиц в оседающей фракции и определить процентное содержание этой фракции в анализируемой дисперсной системе.
Такой метод дисперсионного анализа получил название седиментационного анализа. Этим методом можно определить и удельную поверхность дисперсной фазы по уравнению
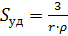 , (7)
, (7)
Для седиментационного анализа используют простые по конструкции приборы - седиментометры. С помощью седиментометров анализируют грубодисперсные системы с размером частиц от 200 до 1 мкм.
На рис. 3 показана схема седиментометра Фигуровского. В этом приборе к упругому стеклянному или кварцевому стержню 1 на стеклянной нити 2 подвешивается чашечка 3, на которой по мере оседания накапливается осадок суспензии. Изменение прогиба стержня, а, следовательно, и массы вещества на чашечке фиксируется с помощью микроскопа со специальной шкалой 4.

| 
|
| Рис. 2 Седиментационное равное | Рис. 3 Седиментометр Фигуровского |
На основе результатов седиментапионного анализа вначале получают зависимость массы осевшего осадка от времени и строят график этой зависимости, называемый кривой седиментации (рис. 4. Зная высоту столба суспензии в цилиндре (Н), общую массу дисперсной фазы, массу осевшей фракции (m) и время её осаждения, можно определить скорость её осаждения по формуле
 , (8)
, (8)
где Q/H -масса дисперсной фазы в объеме, приходящаяся на единицу длины столба суспензии. Затем по формуле (5) определяют средний радиус частиц каждой фракции. Полученные результаты представляют в виде кривых распределения частиц по размеру. Такая кривая для суспензии глины в воде показана на рис. 5. На оси абсцисс откладывают значения радиусов частиц, а на оси ординат - отношение приращения массовых долей к разности радиусов частиц соседних фракций Δx/Δri.

| 
|
| Рис.4 Кривая седиментации | Рис. 5 Кривая распределения частиц по радиусам |
Кривые распределения характеризуют степень полидисперсности системы. Чем меньше r мин отличается от r макc и чем больше максимумы кривой распределения, тем ближе система к монодисперсной. Если частицы в микрогетерогенных дисперсных системах (суспензиях) очень малы и их размеры приближаются к размерам частиц золей, то седиментация только под действием сил тяжести протекает очень медленно. В табл. 5 приведены скорости седиментации частиц кварца ( =2,7 г/см3) различного размера в воде
=2,7 г/см3) различного размера в воде
( =10-3 Па*с), рассчитанные по уравнению (5).
=10-3 Па*с), рассчитанные по уравнению (5).
Таблица 5
Скорость седиментации сферических частиц SiO2 в воде
| Радиус частицы | 0,1 | 0,01 | 0,001 | ||
| Скорость седиментации, см/с | 3,6*10-2 | 3,6*10-4 | 3,6*10-6 | 3,6*10-8 | 3,6*10-10 |
| Время оседания частицы на 1 см | 28 с | 46,5 мин | 77,5 ч | 323 дн | 89 лет |
Поскольку оседание частиц коллоидной степени дисперсности под действием силы тяжести происходит медленно, обычные методы седиментационного анализа для изучения коллоидных растворов неприменимы. Для ускорения оседания коллоидных частиц и определения их размеров используют ультрацентрифуги - приборы с большим числом оборотов, которые способны развивать центробежную силу в миллион раз превышающую поле земного тяготения. С помощью ультрацентрифуг можно также определить размеры и молекулярную массу молекул высокомолекулярных соединений.
Седиментация в природе приводит к образованию осадочных горных пород, в которых залегает нефть, осветлению воды в водоемах и т.д.
Закономерности седиментации лежат в основе разделения фаз отстаиванием, центрифугированием.
В нефтепромысловой практике седиментацию используют: для очистки нефти, а также природной и сточной вод от примесей взвешенных частиц, для очистки буровых растворов от выбуренной породы.