Перейдем теперь ктитрованию слабых кислот сильными основаниями. При вычислении рН, очевидно, уже нельзя концентрацию Н+-ионов приравнивать к общей концентрации кислоты в растворе, так как главная масса ее присутствует в виде неионизированных молекул и только незначительная часть ионизирует с образованием Н+.
Поэтому при вычислении рН здесь исходят из уравнения константы ионизации соответствующей слабой кислоты. Для расчета кривой титрования необходимо вывести три формулы:
- расчет [Н+] (рН) до титрования, т. е. в растворе слабой кислоты;
- расчет [Н+] (рН) в процессе титрования, когда в растворе присутствует слабая кислота и ее соль;
- расчет [Н+] (рН) в точке эквивалентности, когда в растворе находится только соль слабой кислоты и сильного основания.
CH3COOH + NaOH → CH3COONa + H2O
Прежде всего рассчитаем [Н+] и рН в растворе слабой кислоты НАn по формуле:

Pасчет [Н+] (рН) в процессе титрования, когда в растворе присутствует слабая кислота и ее соль:

Приведем теперь формулу для расчета [Н+] и рН в точке эквивалентности, когда в растворе присутствует соль МеАn, образованная слабой кислотой и сильным основанием. Формула расчета рН в точке эквивалентности:

Рассмотрим в качестве примера титрование уксусной кислоты щелочью. Допустим, что 100 мл0,1 н. раствора СН3СООН титруют 0,1 н. раствором NaOH. Поскольку  ,
, 

По формуле 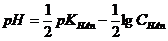 находим:
находим:

Такова величина рН 0,1 н. раствора уксусной кислоты, соответствующая начальной точке кривой титрования. Перейдем к расчету значений рН в процессе титрования СН3СООН.
Прежде всего рассчитаем, какова будет величина рН раствора в тот момент, когда оттитровано 50% уксусной кислоты (т. е. к раствору прибавлено вдвое меньше щелочи, чем требуется по уравнению реакции, именно 50 млщелочи на 100 мл кислоты). Оттитрованная часть кислоты превратилась в соль. Поэтому отношение Скисл:Ссоли равно отношению числа миллилитров неоттитрованной кислоты к числу миллилитров оттитрованной кислоты (или к равному ему числу миллилитров прибавленной щелочи). Следовательно, в данный момент

Таким образом, в тот момент, когда оттитрована как раз половина всей слабой кислоты, рН раствора равен рKкисл. Нужно отметить, что в процессе титрования раствор до точки эквивалентности является буферной смесью (кислота+соль кислоты), что определяет медленное и постепенное изменение рН в процессе титрования.
Особый практический интерес представляет область скачка на кривой титрования. Она лежит в пределах значений рН от момента, когда оставалось 0,1 мл неоттитрованной свободной уксусной кислоты, до момента, когда прибавлено 0,1 млизбытка щелочи. Следовательно, для момента начала скачка

Вычислим по формуле

рН в точке эквивалентности при титровании 0,1 н. раствора СН3СООН 0,1 н. раствором NaОН (или наоборот). Так как изменением объема при титровании пренебрегают, концентрацию соли (Ссоли) считаем равной начальной концентрации кислоты, т. е. 0,1 М. Следовательно

Переходим теперь к вычислению рН для тех моментов титрования, когда к раствору прибавлен избыток NаОН. Последний присутствует в растворе вместе с образовавшейся при реакции солью СН3СООNа, растворы которой имеют щелочную реакцию и поэтому, казалось бы, должны повышать создаваемый рН. В действительности повышение настолько незначительно, что с ним можно не считаться. Другими словами, можно принять, что величина рН определяется исключительно присутствующей в растворе свободной щелочью NаОН,. т. е. концентрацию ОН- можно считать равной общей концентрации NаОН. В конце скачка избыток NаОН равен 0,1 мл0,1 н. раствора в объеме 100 мл.
На основании полученных данных строим, как обычно, кривую титрования.

Кривая титрования 0,1н раствора CH3COOH 0,1н раствором NaOH
Таблица. Изменение рН при титровании 100 мл 0,1 н. раствора СН3СООН 0,1 н. раствором NaOH (или наоборот)
| Прибавлено NaOH, мл | Избыток, мл | Скисл./Сщел. | Вычисления | рН | |
| кислоты | щелочи | ||||
| - | - | 
| 2,88 | ||
| 2,0 | - | 98,2 | 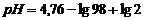
| 3,07 | |
| 15,0 | - | 85/15 | 
| 4,01 | |
| 31,0 | - | 69/31 | 
| 4,41 | |
| 50,0 | - | 50/50 | 
| 4,76 | |
| 90,0 | - | 10/90 | 
| 5,71 | |
| 99,0 | 1,0 | - | 1/99 | 
| 6,76 |
| 99,9 | 0,1 | - | 0,1/99,0 | 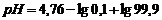
| 7,76 |
| (точка экв.) | - | - | - | 
| 8,88 |
| 100,1 | - | 0,1 | - | [OH-]=10-4; [H+]=10-10 | |
| 101,0 | - | 1,0 | - | [OH-]=10-3; [H+]=10-11 | |
| 110,0 | - | - | [OH-]=10-2; [H+]=10-12 | ||
| 200,0 | - | - | [OH-]=10-1; [H+]=10-13 |
Сравнивая эту кривую с кривой титрования 0,1 н. раствора НСl, видим, что:
- точка эквивалентности уже не совпадает здесь, как в случае НСl, со значением рН=7, а находится в области рН>7, именно при рН 8,88;
- скачок рН на кривой титрования меньше, чем при титровании НСl, а именно находится в области от рН=7,76 (при 0,1 млизбытка кислоты) до рН=10 (при 0,1 млизбытка щелочи);
- при титровании уксусной кислоты из четырех наиболее употребительных индикаторов может быть применен только один фенолфталеин. Что касается метилового оранжевого, то окраска его, отвечающая рН 4, появляется в тот момент, когда оттитровано всего 15% от общего количества СН3СООН. Ясно, что применение этого индикатора при титровании уксусной кислоты неприемлемо.
Причина отмеченного выше уменьшения скачка на кривой титрования уксусной кислоты по сравнению с кривой титрования соляной кислоты заключается в следующем: СН3СООН как слабая кислота создает в растворе гораздо меньшую концентрацию Н+, чем НСl. Поэтому и скачок на кривой титрования начинается здесь при более высоком значении рН (7,76), чем для НС1 (рН 4). Оканчивается же он в обоих случаях одинаково (при рН 10), так как титруют одним и тем же раствором щелочи.
Из сказанного следует, что чем слабее титруемая кислота, тем меньше становится скачок рН кривой титрования. Это иллюстрируется рис., из которого видно, что при K=10-9 скачок исчезает совершенно. Следовательно, титрование подобных очень слабых кислот в водных растворах ни с одним из индикаторов невозможно.

Связь между константой ионизации титруемой кислоты и величиной скачка на кривой титрования