Сосудистая стенка
Сосудистый эндотелий
Нормальный эндотелий действует как мощная антикоагулянтная поверхность, предотвращая тромбообразование. Это достигается благодаря:
1. Выделение в кровоток физиологических антигоагулянтов (глюкозаминогликаны, комплексы гепаран-антитромбин III, ингибитор пути тканевого фактора (TFPI) протеин С и S).
2. Активация фибринолиза – образование плазминогена, тканевого активатора плазминогена (t-PA), урокиназы (u-PA), тромбомодулина, протеина С.
Тромбомодулин
Антикоагулянтная активность эндотелия связана с наличием специфического мембранного белка - тромбомодулина. На поверхности интактного эндотелия содержится значительное количество ТМ. Тромбомодулин с высокой аффинностью связывает тромбин, меняя «направленность» его действия. Комплекс тромбин-тромбомодулин активирует протеин С. Последний в комплексе с протеином S ингибирует активные факторы каскада коагуляции Va и Villa. Другой функцией комплекса тромбин-тромбомодулин является активация прокарбоксипептидазы Y до активного ингибитора - карбоксипептидазы Y или тромбин-активируемого ингибитора фибринолиза (TAFI), который замедляет фибринолиз.
3. Ингибирование адгезии и агрегации тромбоцитов, вазодилатация (продукция простациклина, оксида азота, АДФазы).
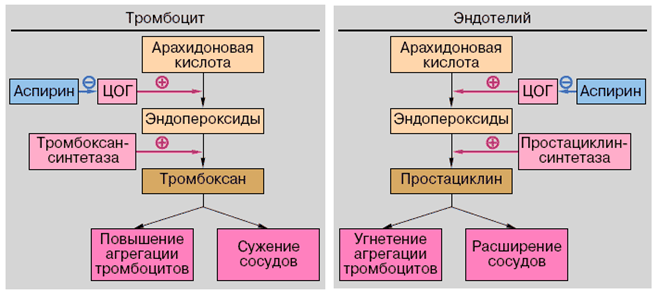
ПРОСТАЦИКЛИН – простагландин I, мощный сосудорасширяющий и антиагрегационный агент, антагонист тромбоксана A2. Антиагрегационное действие простациклина связано со способностью активировать аденилатциклазу тромбоцитов. Это ведет к увеличению синтеза цАМФ, удалению ионов Са2+ в пулы хранения и снижению способности тромбоцитов к агрегации
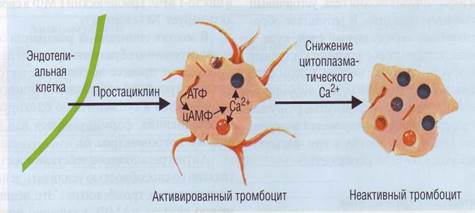
Эндотелий ингибирует активацию тромбоцитов за счет выработки простациклина
ОКСИД АЗОТА (NO) – эндотелиальный фактор релаксации. NO поддерживает нормальный базальный тонус сосудов, нормализуя их реактивность, способность к дилятации. Обладает антиагрегационным, антиадгезивным свойствами.
ЭНДОТЕЛИАЛЬНЫЙ ФАКТОР ГИПЕРПОЛЯРИЗАЦИИ вызывает открытие калиевых каналов в гладких мышцах, что вызывает расслабление сосудов. В отличие от оксида азота этот фактор выделяется не постоянно, а только под действием некоторых стимулов: ацетилхолина, брадикинина, тромбина, гистамина, субстанции Р, АДФ, АТФ.
НАТРИЙУРЕТИЧЕСКИЙ ПЕПТИД С-типа (НПС), ПНУФ (предсердный натрийуретический фактор - по другой терминологии) — один из трех членов семейства натрийуретических пептидов. В отличие от предсердного и мозгового натрийуретических пептидов этот фактор, по-видимому, образуется в основном в эндотелии и некоторых клетках крови и участвует в локальной регуляции сосудистого тонуса. НПС – вазодилятатор и дезагрегант.
4. Извлечение из кровотока активированных факторов свертывания.
Кроме того эндотелий обеспечивает структурную и функциональную целостность сосудистой стенки, межклеточное взаимодействие и образование диффузного барьера, который предотвращает попадание крови из внутрисосудистого пространства во внесосудистое (синтез в субэндотелий коллагена, эластина фибронектина и других веществ).
Но после стимуляции или травмы эндотелий трансформируется в мощную прокоагулянтную поверхность. Повреждение стенок сосудов, что сопровождается оголением субэндотелия, способствует активации свертывания крови и первичного гемостаза следующими путями:
1. Выделение в кровь тканевого тромбопластина, фактора V и других прокоагулянтов
2. Продукция плазменных кофакторов адгезии и агрегации тромбоцитов (ф. Виллебранда (VWF), фактора активации тромбоцитов (PAF) и др.)
3. Выделение вазоконстрикторов (эндотелин-1, норадреналин)
4. Продукция ингибиторов фибринолиза (PAI-1, PAI-2), на стимулированных эндотелиальных клетках снижается количество тромбомодулина.
5. Происходит изменение фосфолипидного состава наружной поверхности мембраны эндотелиальных клеток с появлением рецепторов для ферментных комплексов коагуляционного каскада.
- Контактная активация тромбоцитов коллагеном субэндотелия
Наиболее значимыми стимулами, активирующими эндотелиоциты, являются воспалительные цитокины, эндотоксины, тромбин, гистамин, гипоксия, свободные радикалы кислорода, турбулентные потоки крови, внутриклеточные инфекционные агенты, механические повреждения, иммунные комплексы и др.
Тромбоциты
Тромбоциты, или кровяные пластинки, вырабатываются мегакариоцитами костного мозга. Это безъядерные фрагменты их цитоплазмы. У здорового человека количество тромбоцитов в периферической крови подвержено значительным колебаниям в течение суток - от 150 до 350 • 109/л. Средняя продолжительность жизни тромбоцитов в норме в пределах 7 дней.
В состоянии покоя тромбоцит представляет собой дискообразный осколок мегакариоцитов с гладкой цитоплазматической мембраной, поддерживаемой микротубулиновым кольцом.
Важное свойство мембраны интактных тромбоцитов - это разный фосфолипидный состав наружной и внутренней поверхности. Основные фосфолипиды, входящие в состав тромбоцитов, можно разделить на 2 группы: 1) не обладающие прокоагулянтной активностью холиновые: фосфатидилхолин (ФХ) и сфингомиелин (СФ), 2) обладающие прокоагулянтными свойствами кислые: фосфатидилсерин (ФС), фосфатидилэтаноламин (ФЭ) и фосфатидилинозитол (ФИ). Фосфолипиды первой группы распределены как на наружней, так и на внутренней поверхности клеточной мембраны неактивированных тромбоцитов. Фосфолипиды второй группы в неактивированных тромбоцитах локализованы преимущественно на внутренней поверхности клеточной мембраны. В процессе активации тромбоцита концентрация ФС, ФЭ и ФИ на наружной поверхности значительно возрастает и образует прокоагулянтную поверхность, необходимую для фиксации, активации и взаимодействия плазменных белков гемостаза. Кроме того, это перераспределение меняет вязкость клеточной мембраны, что тоже важно для протекания гемостатических реакций. Кислые фосфолипиды мембраны тромбоцитов - ФС, ФИ и ФЭ называют фактором 3 тромбоцитов (ф.З, PF3), или тромбоцитарным тромбопластином.
Цитоплазматическая мембрана тромбоцитов внедряется внутрь клетки с образованием многочисленных переплетенных канальцев, связанных с внеклеточным пространством. Эта система называется «открытой канальцевой системой» (ОКС). Сократительные филаменты распространяются по всей цитоплазме и обуславливают изменение формы тромбоцита при его активации. В цитоплазме тромбоцита обнаруживается 4 типа гранул:
а-гранулы – содержат факторы, участвующие в процессах гемокоагуляции, воспаления, иммунных реакций, репарации (антигепариновый фактор, β-тромбоглобулин (ингибитор синтеза простациклина эндотелиоцитами), PAI-1, vWF, акцелератор-глобулин (аналог фактора V плазмы), фXI, фXIII, ВМК, тромбоцитарный фактор роста (PDGF) –стимулятор пролиферации эндотелиоцитов, гладкой мускулатуры и фибробластов, фибронектин (укрепляет тромб на повреждённой поверхности).
Плотные гранулы – представляют собой хранилище АДФ, АТФ, серотонина и ионов кальция.
Лизосомальные гранулы – содержат гидролитические ферменты.
На мембране тромбоцитов экспрессируются большое количество рецепторов, но наибольший интерес представляют гликопротеиновые рецепторы адгезии и агрегации (GP).
Гликопротеин I состоит из двух дисульфидносвязанных субъединиц - Iа и Ib. GP Iа является рецептором адгезии к коллагену а и необходим для полноценной адгезии (прилипания) тромбоцита к субэндотелию. Гликопротеин GP1b является рецептором для фактора Виллебранда и для тромбина. Взаимодействие GPIb с фактором Виллебранда (или тромбином) приводит к активации тромбоцитов. При аномалии тромбоцитов содержание гликопротеина Ib в тромбоцитах резко снижено и пластинки не агрегируют под действием тромбина (болезнь Бернара-Сулье).
GP IIb/IIIa – рецептор агрегации взаимодействующий с фибриногеном. Особенность – роль рецептора IIbIIIa осуществляет только на активированных тромбоцитах (активация тромбоцитов приводит к конформационным изменения GPIIbIIIa и связыванию с фибриногеном). При врожденном дефиците GPIIbIIIa развивается тромбоастения Гланцмана, при которой тромбоциты не способны связываться с фибриногеном. Тромбоастения Гланцмана характеризуется тяжелыми рецидивирующими кровотечениями слизистых.
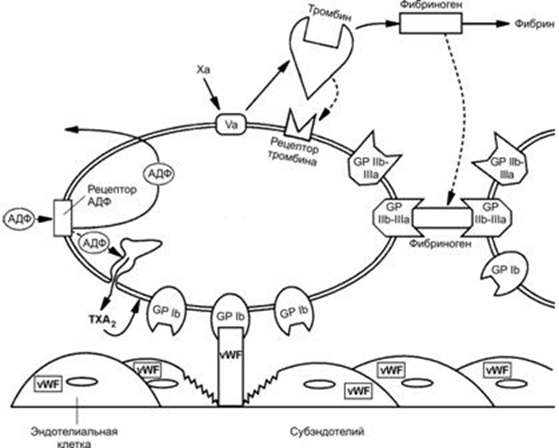
Рецепторы адгезии покоящихся тромбоцитов обладают высоким сродством к своим лигандам, что обеспечивает спонтанную адгезию тромбоцитов. GP IIb-IIIa (рецептор агрегации) – замаскирован, поэтому тромбоциты в состоянии покоя не способны к агрегации. Однако, активация тромбоцитов приводит к конформационному изменению GP IIb-IIIa, которое способствует связыванию фибриногена с тромбоцитарной мембраной, что в свою очередь приводит к агрегации.
Функции тромбоцитов:
1. Ангиотрофическая – способность поддерживать нормальную структуру и функцию сосудов
2. Способность поддерживать спазм поврежденных сосудов путем секреции вазоактивных веществ (норадреналин, серотонин, тромбоксан и т.д.)
3. Способность закупоривать поврежденные сосуды путем образования тромбоцитами белого тромба. Это зависит от:
А) адгезии – приклеивании тромбоцитов к субэндотелию
Б) агрегации – склеивание тромбоцитов друг с другом
В) образование, накопление и секреция факторов адгезии и агрегации
Г) участие в плазмокоагуляции.
Одним из важнейших клеточных эффектов в системе гемостаза является реакционная способность тромбоцитов к образованию агрегатов и адгезии к чужеродным поверхностям. При контакте с коллагеном субэндотелия поврежденного сосуда тромбоциты адгезируют к нему через белковые мостики - VWF, образуя однослойную выстилку, к которой из истекающей крови налипают другие тромбоциты. Этот эффект носит название агрегация.
Сосудисто-тромбоцитарный (первичный) гемостаз обеспечивается сосудистой стенкой и тромбоцитами.
Цель – начальная остановка кровотечения
Результат – образование тромбоцитарной пробки (белого тромба) в месте повреждения сосуда.
Этапы:
1. Местная вазоконстрикция.
Незамедлительной реакцией на травму сосудистого эндотелия является вазоконстрикция. Эта преходящая реакция длительностью менее 60 с приводит к снижению кровотока, что улучшает взаимодействие между тромбоцитами, факторами свертывания крови и поврежденным участком. Первичный сосудистый спазм быстро сменяется парезом прекапиллярных сфинктеров и повышением проницаемости капилляров. Это связано вначале с действием гистамина, высвобождающегося из тучных клеток соединительной ткани в очаге поражения, а затем – с включением калликреин-кининовой системы.
Ведущую роль в модуляции этих изменений выполняет эндотелин.
Эндотелин (ЕТ) - пептидный гормон, состоящи 21 аминокислоты, относится к группе цитокинов, имеет 3 изоформы (ЕТ-1, ЕТ-2 и ЕТ-3). Образуется эндотелин из предшественника пре-про-ЕТ при участии металлопептидазы - эндотелинпревращающего фермента.
ЕТ-1 - наиболее сильный вазоконстриктор из всех известных факторов, доминирует в эндотелиальных клетках сосудов человека. Он также присутствует в небольших количествах в гладких мышечных клетках (ГМК) и кардиомиоцитах. ЕТ не хранится в клетках, а постоянно синтезируется de novo. Синтез ЕТ и освобождение его из эндотелиальных клеток стимулируют тромбин, адреналин, ангиотензин, вазопрессин, некоторые цитокины.
Большая часть ЕТ секретируется внутрь сосудистой стенки, где расположены специфичные высокоаффинные рецепторы. ЕТ, секретируемый наружу, взаимодействует с собственными рецепторами на клеточной мембране, а также стимулирует ангиотензинпревращающий фермент (АПФ), который переводит неактивный ангиотензин I в вазоконстриктор ангиотензин II. Рецепторы для эндотелина сопряжены с G-белками, присутствуют в 2 формах: ЕТ-А и ЕТ-В. Рецепторы ЕТ-А характеризуются высокой аффинностью и постоянно экспрессированы в миокарде на ГМК сосудов. Они обеспечивают прямое вазоконстрикторное действие эндотелина за счет активации поступления Са2+ в клетку через неселективные ионные каналы. Рецепторы ЕТ-В экспрессированы на эндотелиальных клетках и ГМК в отдельных сосудистых бассейнах. Стимуляция ЕТ-В сопровождается освобождением N0 (вазодилататор), тромбоксана (вазоконстриктор) и PGI2 (вазодилататор). Таким образом, один и тот же фактор реализует две противоположные сосудистые реакции (сокращение и расслабление), вызываемые различными химическими механизмами.
Адгезия тромбоцитов
А) непосредственное прилипание тромбоцитов к коллагену посредством рецепторов GP
В) прилипание тромбоцитов к коллагену и фибронектину при помощи фактора Виллебранда (белок сыворотки крови имеющий центры связывания с тромбоцитами, коллагеном и фибронектином).
Фактор Виллебранда (vWF) - один из самых больших гликопротеидов плазмы, имеет молекулярную массу от 540 до нескольких тысяч кДа, содержит в цепочке более 2000 аминокислот. актор Виллебранда состоит из ряда полимеров прогрессивно увеличивающейся молекулярной массы: разделяют легкие, средние, тяжелые и сверхтяжелые мультимеры. Молекулярная масса vWF варьирует от 540 кДа у димеров до 20 тысяч кДа у самых крупных мультимеров, содержащих от 50 до 100 субъединиц. Самым большим тромбогенным потенциалом обладают молекулы vWF с наибольшей молекулярной массой. В плазме нет мономеров фактора Виллебранда, он всегда образует комплексы. Концентрация vWF в плазме составляет примерно 10 мкг/мл.
Основными функциями фактора Виллебранда являются:
• опосредование адгезии тромбоцитов к субэндотелиальным структурам, в первую очередь
к коллагену, и последующей агрегации тромбоцитов (участие в первичном сосудисто-тромбоцитарном гемостазе);
• связывание свободного фактора VIII и защита его молекулы от преждевременной инактивации (участие во вторичном плазменном гемостазе).
Молекулы vWF специфически связываются с рецепторами тромбоцитов GPIb и коллагеном субэндотелия. Это обеспечивает прочную фиксацию тромбоцитов к субэндотелиальным структурам. Помимо GPIb, с фактором Виллебранда также связывается GPIIb-IIIа. Возможно, что это взаимодействие является ключевым в процессе агрегации в местах сосудистого русла с высокой скоростью тока крови.
При взаимодействии рецепторов тромбоцитов с лигандами происходит активация Са2+ –инозитолфосфатного механизма передачи сигнала через мембрану. В результате активируется фермент фосфолипаза А2, которая высвобождает арахидоновую кислоту из мембранных фосфолипидов. Арахидоновая кислота окисляется по циклооксигеназному пути с образованием тромбоксана А2, который секретируется в реакции «высвобождения». С другой стороны, ионы кальция активируют фосфорилирование легких цепей миозина и сокращение тромбостенинового кольца, в результате чего гранулы по микротрубочкам секретируются и высвобождаются факторы активирующие адгезию и агрегацию.
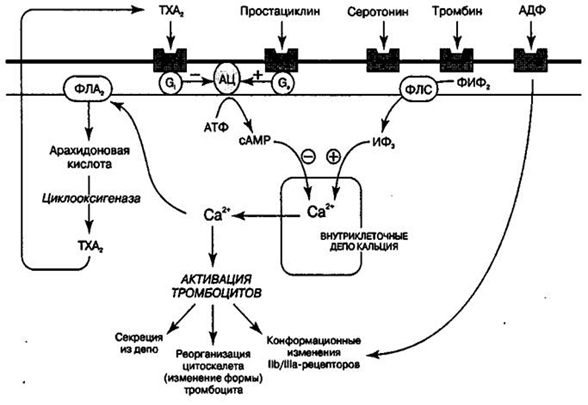
При сокращении тромбостенина возникает контракция тромбоцитов, происходит изменение физико-химических свойств мембраны тромбоцита вследствие транслокации аминосодержащих фосфолипидов (фосфатидилаэтаноламинов, фосфатидилсеринов). Мембрана приобретает свойство образовывать псевдоподии, в результате резко увеличивается поверхность. Контрактированные тромбоциты приобретают способность склеиваться друг с другом в результате изменения конформации рецептора GP IIb-IIIa.
3. Агрегация тромбоцитов.
После фиксации тромбоцитов на субэндотелии, они распластываются на сосудистой стенке. Другие тромбоциты покидают кровоток и оседают на распластанных тромбоцитах. В конечном итоге формируется гемостатическая пробка – группа активированных тромбоцитов, соединенных друг с другом нитями фибриногена и прикрепленных фактором Виллебранда к субэндотелию.
Кроме того, поверхность тромбоцитов изменяется, т.е. появляется новая, «чужеродная» поверхность, т.е. формируется тромбоцитарный тромбопластин на котором происходит фиксация и активация факторов свертывания крови.


Первичный гемостаз регулируется простагландинами – простациклином и тромбоксаном А2.
| ПРОСТАЦИКЛИН | ТРОМБОКСАН |
| Синтезируется эндотелие | Синтезируется тромбоцитами |
| Активирует аденилатциклазу | Активирует инозитолфосфатный механизм |
| Повышает концентрацию цАМФ | Повышает уровень ионов кальция |
| Расширяет сосуды | Вызывает сокращение сосудов |
| Ингибирует агрегацию тромбоцитов | Стимулирует агрегацию тромбоцитов |
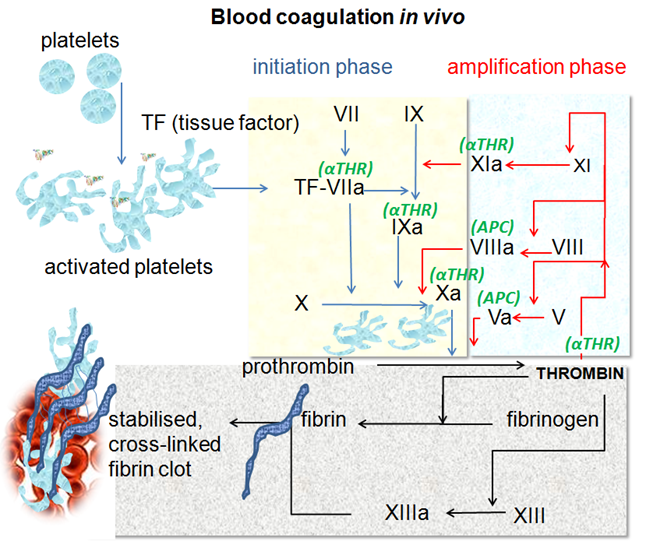
КОГУЛЯЦИОННЫЙ ГЕМОСТАЗ
Образовавшаяся в результате первичного гемостаза тромбоцитарная пробка достаточно рыхлая. Этого достаточно для окончательной остановки капиллярного кровотечения. Однако в более крупных сосудах она постепенно вымывается током крови, что может привести к возобновлению кровотечения. Поэтому первичная тромбоцитарная пробка («белый» тромб) укрепляется фибрином с включением других форменных элементов крови, в результате чего образуется «красный» тромб. Это происходит в результате активации коагуляционного (вторичного) гемостаза.
Вторичный, или коагуляционный, гемостаз – многоэтапный ферментативный процесс, в котором участвуют ферментативные белки плазмы и тканей, надмолекулярные образования и ионы кальция, при котором происходит формирование фибринового сгустка, который повышает плотность тромба и закрепляет его на сосудистой стенке в месте повреждения.
Цель – окончательная остановка кровотечения.
Результат – образование фибрина и формирование красного тромба.

Неферментативные факторы свертывания крови (V и VIII)
Факторы Va и VIIIa не обладают протеолитической активностью, а являются кофакторами для реакций активации фактора X (кофактор IXa фактрора – VIIIa, входит в состав теназного комплекса) и реакции превращения протромбина (II) в тромбин (IIa) (кофактор Ха фактора – Va, входит в состав протромбиназы). VIII и V факторы активируются тромбином, методом частичного протеолиза. Ингибитором VIIIa и Va служит активированный протеин С (APC).
В коагуляционном гемостазе условно выделяют 3 стадии:
I стадия – это активация фермента тромбиназы (Ф.Xа)
II стадия – это активация под действием тромбиназы протромбина (Ф.II) и переход его в активный фермент – тромбин (Ф.IIa)
III стадия – переход растворимого фибриногена (Ф. I) в нерастворимый фибрин (Ф.I ais) под действием тромбина.
Повреждение
TF + VIIa (внешняя теназа)
Протромбин (Ф.II)
 |
Тромбиназа фибриноген (Ф.I)
Ф.Xа
 Тромбин (Ф.IIa)
Тромбин (Ф.IIa)
 Фибрин (Ф.Iais)
Фибрин (Ф.Iais)
 |
 Активация факторов свертывания происходит на «чужеродных» поверхностях – тромбопластинах. Тромбопластином для тромбина и тромбиназы являются фосфолипиды агрегированных тромбоцитов – тромбоцитарный тромбопластин (ф.3).
Активация факторов свертывания происходит на «чужеродных» поверхностях – тромбопластинах. Тромбопластином для тромбина и тромбиназы являются фосфолипиды агрегированных тромбоцитов – тромбоцитарный тромбопластин (ф.3).
Поверхностью для активации проконвертина (VII) является тканевой тромбопластин – тканевой фактор (TF) (Ф.III).
Этот комплекс (Ф.III, Ф.VIIа, ионы кальция) на поверхности контрактированных тромбоцитов (ф.3) активирует тромбиназу (Х).
Тромбиназа связывается при участии Ф.V и ионов кальция с поверхностью тромбоцитарных фосфолипидов (ф.3) и активирует тромбин. Тромбин осуществляет последовательное превращение фибриногена в нерастворимый фибрин.
Полимеризация фибриногена проходит в несколько этапов:
1. под действием тромбина происходит отщепление фибринопептидов А, фибриноген превращается в дезАА-фибриноген
2. сборка дезАА-фибриногена в протофибриллы в шахматном порядке
3. отщепление фибринопептидов В
4. ускорение сборки протофибрилл, образование фибриновых волокон
5. ветвление волокон с образованием трехмерной фибриновой сетки.
6. образование под действием XIIIa изопептидных связей между цепями, что приводит к повышению механической стабильности фибрина и его устойчивости к лизису.
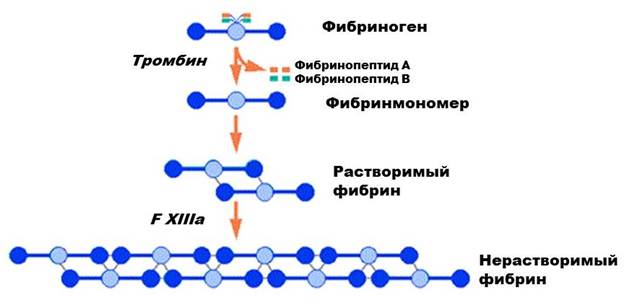
Образуется трехмерная сетчатая структура, стабилизирующая первичную пробку, в которой задерживаются форменные элементы крови.
КЛЕТОЧНАЯ ТЕОРИЯ ГЕМОСТАЗА
В процессе образования свертывания выделяют несколько стадий.
· Инициации
· Амплификации
· Распространения
· Терминация
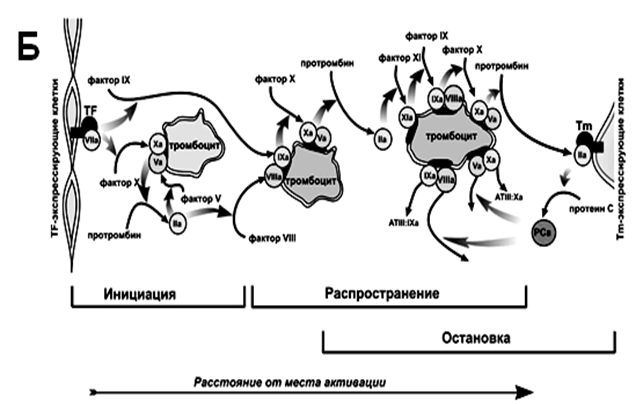
В стадию инициации на тканевом тромбопластине генерируются начальные порции промбина, необходимые для активации агрегации и секреции тромбоцитов. В эту стадию свертывание определяется производством Xa фактора внешней теназой. Однако фактор Xa быстро ингибируется и не может обеспечить достаточные количества тромбина по мере роста тромба (фаза распространения). Поэтому возникает “петля амплификации ”, которая заключается в активации внутренней теназы (IXa, VIIIa). В фазе распространения сгустка фактор Xa образуется внутренней теназой. Однако лимитирующий компонент внутренней теназы, фактор IXa, производится внешней теназой. При дальнейшем росте сгустка дополнительный фактор IXa производится фактором XIa в петле положительной обратной связи – «тромбиновый взрыв».