Активация Свертывания крови in vivo модулируется рядом механизмов, локализующих тромбообразование в месте повреждения и предотвращающих возникновение массивного внутрисосудистого тромбоза.
К таким механизмам относятся:
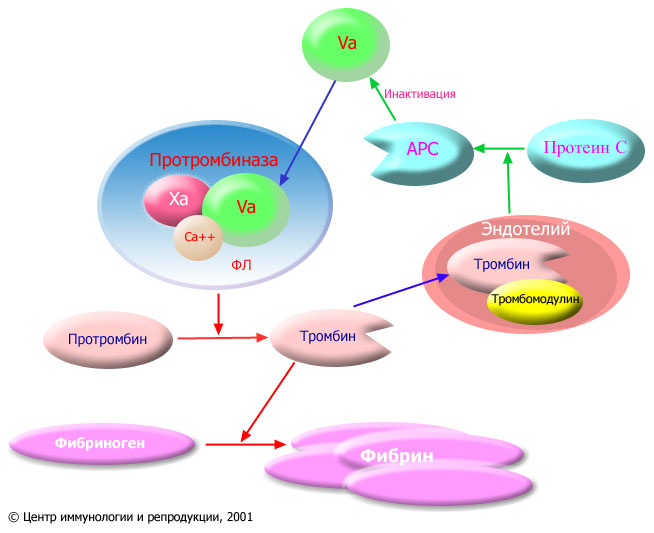
1) протеолитический эффект тромбина. Тромбин in vivo диссоциирует из тромбиназного комплекса и на поверхности эндотелия связывается с тромбомодулином, который меняет активность тромбина. В результате тромбин вызывает протеолиз и деградацию факторов XIa, Va, VIIIa, через активацию протеина С, ограничивая коагуляцию.
2) Ассиметрия биологических мембран.
Ключевые стадии свертывания протекают на поверхности фосфолипидов. Наибольшей прокоагулянтной активностью обладают аминофосфолипиды, но они находятся во внутреннем слое мембран. Ассиметрия в распределении фосфолипидов поддерживается с помощью нескольких ферментов-переносчиков и является одним из механизмов, обеспечивающих отсутствие тромбогенных свойств у мембран неповрежденных или нестимулированных клеток.
С фосфолипидами связано антикоагулянтное действие аннексина V – кальцийзависимого фосфолипид-связывающего белка, ингибирующего фосфолипазу А2 и предотвращающего связывание фактора Xa с прокоагулянтными фосфолипидами.
3) Ингибиторы сериновых протеаз.
1. Серпины (ser ine p rotease in hibitor). Это семейство образовалось в ходе эволюции из одного белка предшественника параллельно с возникновением специализированных протеаз. Механизм действия серпинов состоит в образовании стехиометрического комплекса с протеазой, в котором после расщепления по реактивному центру ингибитор остается ковалентно связанным с серином активного центра фермента. Комплекс протеаза-ингибитор выводится из кровотока и катаболизируется. Таким образом, серпины являются белками, которые выполняют свою функцию один раз в жизни.
Антитромбин III (АТ III) – основной ингибитор тромбина, Ф.Xa, Ф.IXa, а также Ф.XIa, Ф. XIIa, плазмина, трипсина, C1s-компонента комплемента.. АТ III нейтрализует протеазы посредством ковалентного связывания. Скорость нейтрализации сериновых протеаз АТ III в отсутствии гепарина невелика и существенно увеличивается в его присутствии (в 1000 – 100000 раз). Гепарин имеет два сайта связывания с АТIII, а тромбин – один. Гепарин связывается с лизиновыми остатками на АТ III, что делает аргининовый активный центр более доступным для активного серинового центра тромбина. Связывание гепарина с АТIII ускоряет образование комплекса тромбин-АТ III-гепарин. Ковалентная связь между активным сериновым центром тромбина и аргининовым сайтом комплекса АТIII-гепарин вызывает инактивацию активной сериновой потеазыю После образования комплекса между АТ III и тромбином гепарин диссоциирует из комплекса и связывается с другой молекулой АТ III, генерируя множественные циклы инактивации фермента. АТ III представляет собой а2-гликопротеин, синтезирующийся в печени.
Гепариновый кофактор II (ГК II) – серпин, ингибирующий тромбин в присутствии гепарина или дерматан-сульфата. Сродство к гепарину (а значит и биологическая активность) у ГК II на порядок ниже, чем у АТ III, но ГК II обладает высокой специфичностью в отношении тромбина. ГК II секретируется печенью в кровоток, но находится преимущественно во внесосудистом пространстве, где локализуется дерматан-сульфат, и именно здесь может играть решающую роль в ингибировании тромбина.
А1 - антитрипсин (а1-АТ) – нейтрализует Ф. XIIa и активированный протеин С.
2. Кунины – ингибиторы представляющие собой суперсемейство белков, гомологичных апротину.
Ингибитор пути тканевого фактора (ИПТФ) – это гликопротеин, содержащий три куниновых домена. ИПТФ синтезируется в основном эндотелиоцитами, в меньшей степени – макрофагами и гепатоцитами. ИПТФ - это Ф.Xa-зависимый ингибитор комплекса Ф.III (ТФ)-Ф.VIIa. Инактивация происходит в 2 стадии:
1. сначала ИПТФ связывает Ф.Xa и инактивирует его
2. затем комплекс ИПТФ-Ф.Xa связывается с комплексом ТФ-Ф.VIIa и инактивирует его.
4) Система протеина С
Протеин С (ПС) – витамин К-зависимый фермент, расщепляющий Ф.Va и Ф.VIIIa, которые многократно ускоряют две ключевые реакции системы свертывания крови, что приводит к прерыванию каскада активации свертывания крови и развитию гипокоагуляции.
ПС синтезируется гепатоцитами. Секретируется и циркулирует в крови в неактивной форме. ПС связывается с поверхностью эндотелиоцитов посредством кальциевых мостиков.
ПС активируется небольшим количеством тромбина на поверхности неповрежденного эндотелия (т.е. за пределами тромба). Эта реакция значительно ускоряется тромбомодулином, поверхностным белком эндотелиоцитов, который связывается с тромбином опосредованно другим белком – витронектином.
Комплекс тромбин-тромбомодулин становится антикоагулянтным протеином, способным активировать протеин С.
Активированный ПС в присутствии своего кофактора – протеина S – расщепляет и инактивирует Ф.Va Ф.VIIIа, что предотвращает активацию Ф.X и Ф.II за пределами тромба.
Кроме того, активированный ПС подавляет продукцию ингибитора активатора плазминогена (ИАП-1), и тем самым активирует фибринолиз.
8) Система фибринолиза.
Фибринолитическая система осуществляет фибринолиз - процесс лизиса сгустка фибрина или тромба. Лизис тромба называют тромболизисом. Ключевой фермент лизиса фибрина - плазмин, сериновая протеаза, которая образуется из неактивного предшественника - плазминогена при действии физиологических активаторов: тканевого активатора плазминогена (t-PA) и активатора плазминогена урокиназного типа (урокиназа или u-PA). Оба активатора плазминогена принадлежат, как и плазмин, к семейству сериновых протеиназ, имеют общий субстрат - плазминоген и общие ингибиторы - ингибитор активаторов плазминогена типа 1 (PAI-1) и ингибитор активаторов плазминогена типа 2 (PAI-2).
Плазмин расщепляет: фибрин до растворимых продуктов деградации, белки внеклеточного матрикса, активирует другие протеазы и факторы роста. Кроме фибринолиза плазминоген и плазмин участвуют в целом ряде физиологических и патофизиологических процессов, таких как воспаление, миграция клеток, ангиогенез, заживление ран, овуляция, эмбриогенез, рост опухоли, метастазирование и атеросклероз.
Активация плазминогена.
Превращение плазминогена в плазмин катализируется активаторами плазминогена и строго регулируется различными ингибиторами.
Активаторы плазминогена образуются или сосудистой стенкой (внутренняя активация), или тканями (внешняя активация).
Внутренний путь активируется белками «контактной системы»: Ф.XIIa, XIa, высокомолекулярным кининогеном и каллекреином.
Внешний путь активируется в результате действия тканевого активатора плазминогена (ТАП), выделяемого эндотелиальными клетками. ТАП также синтезируется моноцитами, мегакариоцитами и мезотелиальными клетками.
ТАП – сериновая протеаза, осуществляющая ограниченный протеолиз плазминогена.
Урокиназа – другой активатор плазминогена, выявляемый в большом количестве в моче. Продуцируется фибробластами, макрофагами и эндотелиоцитами.