Скорость можно рассчитать по кинетическому уравнению химической реакции. Для химической реакции, протекающей по уравнению аА + вВ = сС
vх.р.= k [A]a ∙ [B]b
Т.е. скорость реакции прямопропорциональна концентрации реагирующих веществ, взятыми в степени равной стехиометрическому коэффициенту в уравнении реакции. k –константа скорости, это скорость реакции при единичных молярных концентрациях исходных веществ, она зависит от природы веществ. Для газообразных веществ вместо понятия «молярная концентрация» принято говорить о парциальном давлении. Парциальное (порция) давление - это часть общего давления, которая определяется числом ударов частиц данного газа по поверхности сосуда, в котором находится система. А это число ударов определяется молярной концентрацией данного газа. Т.е. концентрация и давление газа – величины прямопропорциональные. Поэтому можно сказать, что скорость реакции в которой участвуют газы, зависит от давления, причем прямопропорционально.
Надо учитывать, что это правило верно только для гомогенных реакций, т.е. для реакций, протекающих в одной фазе. Для гетерогенных реакций, когда реагирующие вещества находятся в разных фазах и сталкиваются друг с другом только на границе раздела, скорость зависит прежде всего от величины площади поверхности раздела. Поэтому чтобы увеличить скорость реакции вещества измельчают, в идеале – растворяют. И на скорость влияет концентрация только того вещества, которое находится в жидкой или газообразной фазе.
Важной характеристикой реакции является «порядок реакции». Что это такое? Например:
2Н2 + О2 = 2Н2О – реакция гомогенная, оба исходных вещества – газы и смешиваются друг с другом неограниченно. А реакция 2Mg + О2 = 2MgО – гетерогенная, и сталкиваться частицы могут только на поверхности раздела фаз.
Если скорость зависит от концентрации двух исходных веществ и т.д. обычно это гомогенные реакции, например: 2Н2 + О2 = 2Н2О и vх.р.= k [Н2]2 ∙ [О2]. То это реакция второго порядка.
Если скорость зависит от концентрации какого-то одного исходного вещества, например: 2Mg + О2 = 2MgО и vх.р.= k ∙ [О2], то это реакция первого порядка. А что касается магния, то тут речь не может идти о концентрации металла, а только о степени измельчения.
Скорость реакции может не зависеть от концентрации реагирующих веществ. Например, для каталитических процессов, когда вещества в избытке, а катализатора – считанные молекулы. Скорость в таких случаях зависит от концентрации катализатора, а от концентрации веществ не зависит. Реакция 2SO2 +O2 = 2SO3 протекает только в присутствии катализатора при любой концентрации реагирующих веществ.
В химии практически не встречаются реакции выше 2-го порядка.
Еще одна важная характеристика реакций, которая используется для характеристики изменения концентрации пестицидов, радионуклидов и т.д. в окружающей среде - период полураспада. Это время, за которое прореагирует половина частиц исходного вещества. Это очень важная характеристика, ведь чем больше период полураспада, тем дольше остается в окружающей среде опасное вещество.
6. Как зависит скорость реакции от температуры? Увеличивается. Но как именно? На этот вопрос отвечает правило Вант – Гоффа. Правило эмпирическое. 
Скорость химической реакции увеличивается в 2-4 раза при увеличении температуры на каждые 10 градусов.  = t2 – t1 разница температур, а
= t2 – t1 разница температур, а 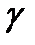 - температурный коэффициент, обычно
- температурный коэффициент, обычно  = 2-4.
= 2-4.
Для ферментативных процессов (предположительно)  =7-10, но 10о – это очень большой диапазон температур для белков. Все жизненные процессы протекают в узком температурном интервале 0-45оС, за пределами которого для большинства организмов жизни нет. Эти границы обусловлены температурой замерзания воды и температурой денатурации белка. А температурный оптимум биохимических процессов – 35-40оС. Но мы должны помнить, что скорость биохимических процессов зависит от температуры еще больше, чем для обычных реакций.
=7-10, но 10о – это очень большой диапазон температур для белков. Все жизненные процессы протекают в узком температурном интервале 0-45оС, за пределами которого для большинства организмов жизни нет. Эти границы обусловлены температурой замерзания воды и температурой денатурации белка. А температурный оптимум биохимических процессов – 35-40оС. Но мы должны помнить, что скорость биохимических процессов зависит от температуры еще больше, чем для обычных реакций.
 Почему же скорость реакций так сильно зависит от температуры? Известно, что скорость реакции определяется числом столкновений молекул друг с другом за единицу времени. Чем больше температура, тем больше скорость движения частиц и больше вероятность столкновений. Но не все столкновения эффективны. Реагируют лишь те молекулы, энергия которых не ниже некоторого предела, называемого энергией активации. Величина этой энергии определяется природой реагирующих веществ. Одни вещества между собой взаимодействуют при н.у., т.е. у реакции низкая энергия активации, для других надо небольшое повышение температуры, а третьи вступают в реакцию при очень высоких температурах. Если реакция термодинамически разрешена, т.е. ее
Почему же скорость реакций так сильно зависит от температуры? Известно, что скорость реакции определяется числом столкновений молекул друг с другом за единицу времени. Чем больше температура, тем больше скорость движения частиц и больше вероятность столкновений. Но не все столкновения эффективны. Реагируют лишь те молекулы, энергия которых не ниже некоторого предела, называемого энергией активации. Величина этой энергии определяется природой реагирующих веществ. Одни вещества между собой взаимодействуют при н.у., т.е. у реакции низкая энергия активации, для других надо небольшое повышение температуры, а третьи вступают в реакцию при очень высоких температурах. Если реакция термодинамически разрешена, т.е. ее  <0, то высокую энергию активации преодолевают за счет внешних факторов: нагревание, облучение УФ и т.д. Но это не всегда экономически выгодно, а на биохимические системы вообще нельзя воздействовать высокими энергиями.
<0, то высокую энергию активации преодолевают за счет внешних факторов: нагревание, облучение УФ и т.д. Но это не всегда экономически выгодно, а на биохимические системы вообще нельзя воздействовать высокими энергиями.
7. Есть и другой путь ускорения химических реакций: катализ. Катализ – изменение скорости химической реакции с помощью особых веществ – катализаторов, которые участвуют в процессе, но к концу реакции остаются неизменными.
Существует теория активного комплекса, согласно которой, условием протекания каталитической реакции является образование промежуточного соединения – «активного комплекса».
Эта теория объясняет действие катализатора образованием активного комплекса с низкой энергией активации между катализатором и веществом. Т.е. если реакция А + В = АВ имеет высокую энергию активации, то в присутствии катализатора К, она идет «другим путем». Сначала А + К = АК, где АК -– не химическое соединение, а переходное состояние с максимальной потенциальной энергией.
Затем АК + В = АВ + К. Обе эти реакции имеют низкую энергию активации.
Катализ бывает:
- положительный и отрицательный – в зависимости от того увеличивается или уменьшается скорость в процессе катализа (отрицательный катализатор обычно называют ингибитором);
- автокаталитический – если катализатором является вещество - продукт реакции;
- кислотно-основный – если катализатором являются ионы водорода;
- гомогенным и гетерогенным – в зависимости от того в одной или разных фазах находятся катализатор и исходные вещества.
Особенности каталитических реакций:
1) катализатор не расходуется в процессе катализа;
2) взаимодействие происходит не по уравнению реакции;
3) катализаторы не влияют на химическое равновесие, они одинаково ускоряют прямую и обратную реакцию;
4) катализаторы чувствительны к посторонним веществам, если это вещество усиливает действие катализатора – его называют промотором (активатором), если ослабляет – каталитически ядом;
5) большинство катализаторов селективны (избирательны).
8. Особую группу катализаторов составляют ферменты (энзимы). Это биологические катализаторы. Их известно приблизительно 2000. Они управляют всеми биохимическими процессами в организме, ни одна реакция в организме не протекает без участия фермента.
Особенности ферментативного катализа:
1) Очень высокая скорость реакций (в 106-1012 раз больше, чем скорость обычных реакций);
Энергия активации ферментативных процессов очень низкая, ферментативный катализ является очень эффективным. Ферментативные реакции принято характеризовать молекулярной активностью. Молекулярная активность фермента – число молекул вещества превращенных 1 молекулой фермента за 1 сек. Для пепсина молекулярная активность равна 20, для амилазы – 300, для холинэстеразы – 300 000.
2) Выше было сказано, что биохимические процессы – реакции нулевого порядка. Скорость ферментативных реакций зависит только от этой концентрации фермента, но не зависит от концентрации вещества (субстрата). Изменение концентрации фермента очень сильно влияет на скорость метаболических процессов. Определение концентрации ферментов (ее называют активностью фермента) в биологических жидкостях позволяет диагностировать различные заболевания (энзимодиагностика). Существует также энзимотерапия – применение ферментов с лечебной целью. Например, мезим-форте.
2) По своей природе все ферменты относятся к белкам. Причем чаще всего это типичные глобулярные белки, имеющие сложную структуру, т.е. строго определенную пространственную форму молекулы. И реагируют молекулы ферментов с молекулами субстрата по принципу «ключик к замочку», т.е. эти молекулы должны соответствовать друг другу по своей форме, как детали детского конструктора. Отсюда высокая специфичность (избирательность) биохимических реакций.
3) Белки легко денатурируют, т.е. при изменении условий изменяют форму глобулы. Поэтому ферментативные процессы протекают в очень мягких условиях и очень сильно зависят от температуры и кислотности среды.
4) Скорость биохимических процессов сильно зависит от присутствия посторонних веществ, которые могут быть активаторами и ингибиторами ферментов. Например: KCN, H2S, CO, пестициды, многие лекарства взаимодействуют с ферментами и мешают образованию активного комплекса; а ионы Mg, Mn, Zn и других металлов-микроэлементов активируют ферменты.
9. Второй закон термодинамики позволяет решать вопрос не только о направленности процесса, но и об условиях термодинамического равновесия. При равновесии параметры и термодинамическими функции системы не изменяются. Но в системе продолжают протекать процессы, просто они противоположно направлены и скорость их равна. Это равновесие динамическое, подвижное.
Состояние химического равновесия описывается законом действующих масс (Гульдберг и Вааге, 1867): В состоянии химического равновесия отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ с учетом стехиометрических коэффициентов, есть величина постоянная при данной температуре, и называется константой равновесия.
Для реакции протекающей по уравнению: аА + вВ  сС + dD
сС + dD

Из этого записи следует, что концентрации всех веществ, участвующих в реакции, связаны между собой, и изменение одной из них влечет за собой изменение другой. Константа равновесия является количественной характеристикой равновесия. Она может меняться от 0 до 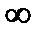 . Если К=0, значит реакция не протекает, концентрация продуктов реакции равна 0. При К >1 равновесие смещено в сторону продуктов реакции, при К < 1 оно смещено к исходным веществам.
. Если К=0, значит реакция не протекает, концентрация продуктов реакции равна 0. При К >1 равновесие смещено в сторону продуктов реакции, при К < 1 оно смещено к исходным веществам.
Закон действующих масс – один из основных законов химии, он позволяет рассчитывать константы равновесия и концентрации веществ при различных химических процессах (диссоциации, гидролиза, растворения и т.д.). Качественное направление сдвига равновесия при изменении внешних условий определяется принципом Ле Шателье: Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в системе ускоряются процессы, направленные на ослабление этого воздействия. Система стремиться вернуться в состояние равновесия, т.к. там ее энергия минимальна. Например, если концентрация продуктов реакции меньше равновесной, то скорость прямой реакции становиться больше, чем обратной, т.к. система ускоряет процессы, идущие с увеличением концентрации продуктов реакции. Уменьшая эту концентрацию, мы можем ускорять прямую реакцию, а увеличивая концентрацию продуктов реакции, мы замедляем ее. Аналогично можно использовать изменение других параметров (температуры, давления), чтобы сдвинуть равновесие в нужную сторону.
Например: 2Н2(г) + О2(г) ↔ 2Н2О (г) + Q Этот процесс при определенных условиях обратим. Рассмотрим, что происходит в прямой реакции: концентрация водорода и кислорода уменьшается (Они вступают в реакцию и расходуются), а концентрация воды (она образуется) – увеличивается. Температура увеличивается (реакция экзотермическая). Давление уменьшается (2 ν + 1 ν ↔ 2 ν). В обратной реакции все наоборот. Поэтому если увеличить температуру, должна ускориться реакция, в которой она уменьшается, т.е. обратная. И равновесие сдвинется к исходным веществам (водороду и кислороду), т.е. их концентрация станет больше, чем до повышения температуры.
Законы термодинамики описывают свойства изолированных гомогенных систем. При применении их к биологическим системам надо учитывать:
1) что живые организмы - системы открытые;
2) что все биологические систем- гетерогенны;