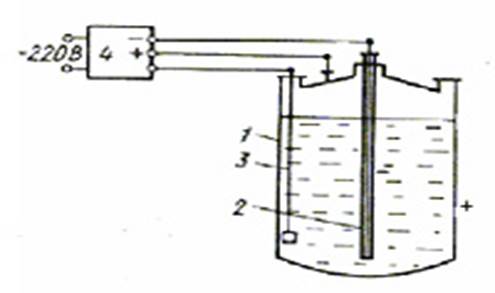
Анодная защита применяется в химических и смежных с ней отраслях промышленности в принципиально иных условиях, чем катодная защита; оба типа электрохимической защиты в агрессивных средах дополняют друг друга. Металл, конструкции или сооружения должны иметь область пассивности с достаточно низкой скоростью растворения, которая лимитируется не только разрушением металла, но и возможным загрязнением среды. Широко применяют анодную защиту для оборудования, работающего в серной кислоте, средах на ее основе, водных растворах аммиака и минеральных удобрений, фосфорной кислоте, в целлюлозно-бумажной промышленности и ряде отдельных производств (например, роданида натрия). Особенно важна анодная защита теплообменного оборудования из легированных сталей в производстве серной кислоты; защита холодильников со стороны кислоты позволяет повысить рабочую температуру, интенсифицировать теплообмен, повысить эксплуатационную надежность. Регулирование потенциала металла осуществляют автоматическими станциями анодной защиты (регуляторами потенциала), работающими с контролем потенциала и управляющим сигналом от электрода сравнения. Вспомогательные электроды изготавливают из высоколегированных сталей, кремнистого чугуна, платинированной латуни (бронзы) или меди. Электроды сравнения - выносные и погруженные, близкие по составу к анионному составу агрессивной среды (сульфатно-ртутные, сульфатно-медные и т. п.). Могут быть использованы любые электроды, имеющие в данной среде какой-либо устойчивый потенциал, например потенциал коррозии (электроды из чистого цинка) или потенциал электрохимической реакции (осаждения покрытия, выделения хлора или кислорода). Зона действия защитных потенциалов зависит от области оптимальной запассивированности металла и изменяется от нескольких В (титановые сплав.) до нескольких десятков мВ (нержавеющие стали при повышенных температурах).
Анодная защита ванн для химического осаждения покрытий обеспечивает защиту ванны от коррозии и случайных осаждений покрытия на стенки ванны. Возможно возникновение вторичной пассивной области потенциалов, расположенных положительнее области питтингообразования, что обеспечивает анодную защиту от питтинговой коррозии. Для стабилизации систем защиты применяют протекторные катоды с высоким положительным потенциалом (графитопластовые электроды), поляризация создается с помощью оксидных электродов или кислородных электродов, используемых в топливных элементах.
Заключение
Электрохимическая защита металлов от коррозии, основана на зависимости скорости коррозии от электродного потенциала металла. В общем случае эта зависимость имеет сложный характер. В принципе, металл или сплав должен эксплуатироваться в той области потенциалов, где скорость его анодного растворения меньше некоторого конструктивно допустимого предела, который определяют, исходя из срока службы оборудования или допустимого уровня загрязнения технологической среды продуктами коррозии. Кроме того, должна быть мала вероятность локальных коррозионных повреждений.
К собственно электрохимической защите относят катодную защиту, при которой потенциал металла специально сдвигают из области активного растворения в более отрицательную область относительно потенциала коррозии, и анодную защиту, при которой электродный потенциал сдвигают в положительную область до таких значений, когда на поверхности металла образуются пассивирующие слои.
Электрохимическая защита имеет широкое применение в современном мире:
· Для защиты судов от морской коррозии
· Для стационарных нефтегазопромысловых сооружений, трубопроводов и хранилищ
· Для подземных сооружений, трубопроводов, кабелей, и скважин
· Для защиты стальной арматуры в железобетоне для свай, фундаментов, дорожных сооружений (в том числе горизонтальных покрытий) и зданий
· В химическом производстве: для промышленных аппаратов, теплообменников и т. д.
Пример. Протекторная защита металлов от коррозии. Как протекает коррозия стальных трубопроводов при использовании цинковых протекторов во влажном грунте?
Решение. Цинк, подсоединенный к трубопроводу, образует гальваническую пару, в которой он, как более активный металл (Е°(Zn2+/Zn) = -0,763 B), является анодом:
(-) Zn | H2O, O2 | Fe (+).
Окислителем при грунтовой коррозии является растворенный во влажном грунте кислород. Процессы, протекающие при коррозии, можно записать следующим образом:
(-)A: Zn0 - 2ē →Zn2+ |2
(+)К: О2 + 2Н2О+ 4ē → 4ОН- |1
Cуммарное уравнение процесса:
2Zn + O2 + 2H2O → 2Zn(OH)2
Катодная защита






Анодная защита