| (наименование учебной дисциплины согласно учебному плану) |
Тема работы: Исследование эффекта Джоуля-Томпсона при адиабатическом истечение газа
| Зарудний Е.А. |
| (Ф.И.О.) |
| (подпись) |
| (шифр группы) |
| (подпись) |
| (Ф.И.О.) |
| (должность) |
Санкт-Петербург
Цель работы:
1) определение изменения температуры углекислого газа при протекании через малопроницаемую перегородку при разных начальных значениях давления и температуры;
2) вычисление по результатам опытов коэффициентов Ван-дер-Ваальса "a" и "b".
Краткое теоретическое содержание:
Явление, изучаемое в работе – эффект Джоуля-Томсона при адиабатическом истечении углекислого газа. Сущность явления: изменение температуры газа при адиабатическом расширении газа без совершения им полезной работы.
Определения:
Адиабатическое расширение – расширение газа без теплообмена с окружающей средой. (Q=0)
Теплообмен – физический процесс передачи тепловой энергии от более горячего тела к более холодному либо непосредственно (при контакте), либо через разделяющую (тела или среды) перегородку из какого-либо материала.
Идеальный газ – модель газа, в которой пренебрегаются размеры молекул по сравнению с расстоянием между ними, т.е. молекулы рассматриваются как материальные точки, также пренебрегаются силы взаимодействия между молекулами (за исключением моментов столкновения). Обычные газы при невысоких давлениях можно рассматривать, как идеальные.
Законы и соотношения:
Первый закон термодинамики – теплота, сообщаемая системе, расходуется на изменение внутренней энергии системы и на совершение системой работы против внешних сил.
Q=∆U+A
Уравнение Менделеева-Клапейрона (идеального газа) – формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа, имеющая вид:

Уравнение Ван-дер-Ваальса (реального газа) – формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой реального газа при помощи коэффициентов Ван-дер-Ваальса, имеющая вид:

Поправка a (в формуле  ) – поправка, учитывающая силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь).
) – поправка, учитывающая силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь).
Поправка b — поправка, учитывающая силы отталкивания (из общего объёма вычитается объём, занимаемый молекулами).
Схема установки:

Газ поступает в систему из баллона 13 через редуктор 12, который позволяет регулировать давление газа в магистрали. Кран 10 позволяет перекрыть поток газа, давление контролируется манометром 11.
Термостат управляется с пульта 7. Пульт содержит задатчик температуры (в °С), переключатели "НАГРЕВ" и "ЦИРК". Переключатель "НАГРЕВ" включает режим поддержания температуры воды внутри термостата равной заданной, при выключенном переключателе "НАГРЕВ" температура воды устанавливается равной комнатной. Индикацией включения нагрева является окрашивание в красный цвет изображения ТЭНа внутри термостата. Переключатель "ЦИРК" включает или выключает циркуляцию воды через водяную рубашку трубы 3. Индикацией включения циркуляции является вращение крыльчатки насоса внутри термостата.
В процессе протекания через пористую перегородку газ испытывает существенное трение, приводящее к ее нагреву. Потери энергии на нагрев трубки в начале процесса могут быть очень существенными и сильно искажают ход явления. После того как температура трубки установится и газ станет уносить с собой все выделенное им в перегородке тепло, формула  становится точной, если, конечно, теплоизоляция трубки достаточно хороша и не происходит утечек тепла наружу через ее стенки.
становится точной, если, конечно, теплоизоляция трубки достаточно хороша и не происходит утечек тепла наружу через ее стенки.
Расчётные формулы:
1. Перепад давлений в теплоизолированной трубке:
 , где
, где
 - разность давлений,
- разность давлений,  = Па;
= Па;
 начальное давление,
начальное давление, 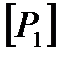 = Па;
= Па;
 атмосферное давление
атмосферное давление  = Па.
= Па.
2. Коэффициент Джоуля-Томсона:
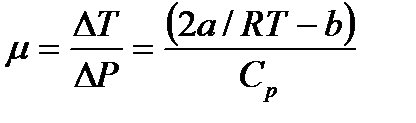 , где
, где
 коэффициент Джоуля -Томсона,
коэффициент Джоуля -Томсона,  =
=  ;
;
 - разность температур,
- разность температур, 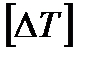 =
=  ;
;
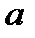 - постоянная Ван-дер-Ваальса,
- постоянная Ван-дер-Ваальса, 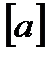 =
=  ;
;
 - универсальная газовая постоянная,
- универсальная газовая постоянная, 
 ;
;
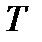 - температура газа,
- температура газа,  = К;
= К;
 - постоянная Ван-дер-Ваальса,
- постоянная Ван-дер-Ваальса,  =
=  ;
;
 - теплоёмкость при постоянном давлении,
- теплоёмкость при постоянном давлении,  = 41
= 41  .
.
3. Температура инверсии:
 , где
, где
 - температура инверсии,
- температура инверсии,  =
=  .
.
4. Температура критическая:
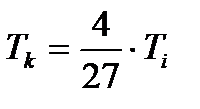 , где
, где
 - температура критическая.
- температура критическая.
Формулы косвенных погрешностей:
1. Абсолютная погрешность измерений коэффициента Джоуля-Томсона:
 , где
, где
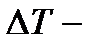 средняя арифметическая ошибка.
средняя арифметическая ошибка.  = К;
= К;
 приборная погрешность барометра,
приборная погрешность барометра,  = Па;
= Па;
 результат изменения температур,
результат изменения температур,  = К;
= К;
 результат изменения давлений,
результат изменения давлений,  = Па;
= Па;
 коэффициент Джоуля -Томсона,
коэффициент Джоуля -Томсона,  =
=  .
.
2. Абсолютная погрешность измерений температуры инверсии:
 , где
, где
 - температура инверсии,
- температура инверсии,  =
=  .
.
 погрешность измерения коэффициента
погрешность измерения коэффициента  ,
, 
 ;
;
 погрешность измерение коэффициента b,
погрешность измерение коэффициента b,  =
=  ;
;
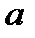 - постоянная Ван-дер-Ваальса,
- постоянная Ван-дер-Ваальса, 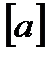 =
=  ;
;
 - постоянная Ван-дер-Ваальса,
- постоянная Ван-дер-Ваальса,  =
= 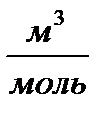 .
.
3. Абсолютная погрешность измерения температуры критической:
 , где
, где  - температура критическая;
- температура критическая;  абсолютная погрешность измерений температуры инверсии;
абсолютная погрешность измерений температуры инверсии;  - температура инверсии,
- температура инверсии,  =
=  .
.
4. Относительная погрешность измерения коэффициента Джоуля-Томсона:
 , где
, где 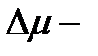 абсолютная погрешность измерений коэффициента Джоуля-Томсона,
абсолютная погрешность измерений коэффициента Джоуля-Томсона, 
 ;
;  коэффициент Джоуля -Томсона,
коэффициент Джоуля -Томсона,  =
=  .
.
Таблица 1. Результаты измерений:
| Физические величины | Т | Р1 | 
| DT | m |
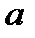
|

| Тинв | Ткр |
| Ед. Изм. № опыта | 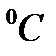
| 105 Па | 105 Па | 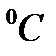
| 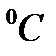 /Па /Па
| 
| 
| 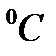
| 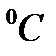
|
| 1,222 | |||||||||
| 8,74 | 1,249 | ||||||||
| 6,52 | 1,304 | 0,014 | 
| -4,778 | -0,708 | ||||
| 4,32 | 1,44 | ||||||||
| 2,14 | 2,14 |
Таблица 2. Результаты измерений:
| Физические величины | Т | Р1 | 
| DT | m |
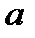
|

| Тинв | Ткр |
| Ед. Изм. № опыта | 
| 105 Па | 105 Па | 
|  /Па /Па
| 
| 
| 
| 
|
| 9,8 | 1,089 | ||||||||
| 7,81 | 1,116 | ||||||||
| 5,83 | 1,166 | 0,014 | 
| -4,778 | -0,708 | ||||
| 3,87 | 1,29 | ||||||||
| 1,93 | 1,93 |
Таблица 3. Результаты измерений:
| Физические величины | Т | Р1 | 
| DT | m |
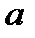
|

| Тинв | Ткр |
| Ед. Изм. № опыта | 
| 105 Па | 105 Па | 
|  /Па /Па
| 
| 
| 
| 
|
| 8,51 | 0,946 | ||||||||
| 6,79 | 0,97 | ||||||||
| 5,09 | 1,018 | 0,014 | 
| -4,778 | -0,708 | ||||
| 3,39 | 1,13 | ||||||||
| 1,69 | 1,69 |
Исходные данные:
P2 – атмосферное давление P2 = 1 атм » 105 Па;
 - универсальная газовая постоянная, R=8,31
- универсальная газовая постоянная, R=8,31  ;
;
 - теплоёмкость при постоянном давлении,
- теплоёмкость при постоянном давлении,  = 41
= 41  .
.
Прямые погрешности:















 , для начальной температуры, равно 20
, для начальной температуры, равно 20 



 (
( ) и экспериментальные данные, полученные при трех значениях температуры, определяем постоянные a и b для углекислого газа по двум парам температур.
) и экспериментальные данные, полученные при трех значениях температуры, определяем постоянные a и b для углекислого газа по двум парам температур.  и
и  - пары температур.
- пары температур. 


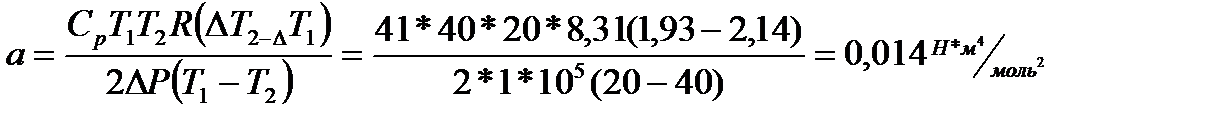

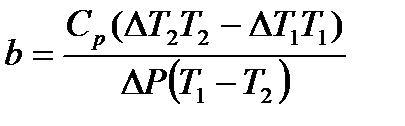



 ;
;


