ДРОБНОЕ ОБНАРУЖЕНИЕ, ОПРЕДЕЛЕНИЕ И ТОКСИКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОТДЕЛЬНЫХ КАТИОНОВ
СВИНЕЦ
Токсикологическое значение свинца
Токсикологическое значение свинца определяется ядовитыми свойствами металлического свинца, его солей и некоторых производных: широким и разнообразным применением их в промышленности и быту.
Из различных соединений свинца наибольшее токсикологическое значение имеют арсенат, ацетат, хромат, карбонат, хлорид, нитрат и ряд других солей этого металла. Оксид свинца применяется для приготовления некоторых красок, входит в состав свинцового пластыря. Свинца карбонат является одним из компонентов свинцовых белил. В состав некоторых красок входит и свинца хромат. Свинца арсенат относится к числу соединений, применяемых для борьбы с вредителями садов и виноградников. Основной свинца ацетат в ряде стран применяется и медицине. Стеарат, олеат и другие соединения свинца с органическими кислотами используются в качестве стабилизаторов при получении пластмасс. Эти соединения используются как добавки к краскам, а также входят в состав некоторых помад и жидкостей для волос.
Особенно опасными в отношении отравлений свинцом являются добыча свинцовых руд, выплавка свинца, производство аккумуляторов, свинцовых красок [свинцовые белила 2РbСО3.Рb(ОН)2 и сурик Рb3О4], применение которых в России ограничивается только окраской судов и мостов, лужение, пайка, применение свинцовой глазури PbSiО3 и т. д. При недостаточной охране труда возможны промышленные отравления.
Источниками бытовых отравлений являлось в ряде случаев недоброкачественно луженая (при употреблении консервов, изготовленных в недоброкачественно луженной посуде), эмалированная, фарфорово-фаянсовая и глиняная посуда, покрытая глазурью. Описаны случаи отравления свинцом через питьевую воду (свинцовые трубы), нюхательный табак, завернутый в свинцовую бумагу, после огнестрельного ранения и т.п. Более известны также случаи отравлений свинцовыми солями и тетраэтилсвинцом.
Основным источником отравлений соединениями свинца является поступление их в пищевой канал.
Ионы свинца, поступившие в организм, соединяются с сульфгидрильными и другими функциональными группами ферментов и некоторых других жизненно важных белковых соединений. Около 90 % ионов свинца, поступивших в кровь, связываются эритроцитами (по Р. Лудевигу и К. Лосу, 1983).
Свинец является протоплазматическим ядом, вызывающим изменения главным образом в нервной ткани, крови и сосудах. Ядовитость соединений свинца в значительной степени связана с растворимостью их и в желудочном соке, и в других жидкостях организма. Хроническое отравление свинцом дает характерную клиническую картину. Смертельная доза различных соединений свинца неодинакова. Дети особенно чувствительны к нему.
Свинец поражает все отделы головного мозга, особенно гипоталамические отделы и ретикулярную формацию ствола. Свинец блокирует ферменты, участвующие в синтезе гема. Развивается гипохромная анемия при нормальном содержании железа сыворотки. Кроме того, свинец повышает гемолиз эритроцитов.
Свинец не относится к числу биологических элементов, но обычно присутствует в воде и пище, откуда поступает в организм. Человек, не занятый работой со свинцом, поглощает в сутки, как указывает Н. В. Лазарев, 0,05 - 2 г свинца (в среднем 0,3 мг). Соединения свинца способны кумулироваться в костной ткани, печени, почках. Около 10% его всасывается организмом, остальное количество выделяется с калом. Свинец откладывается в печени и в трубчатых, несколько меньше в плоских костях. В остальных органах откладывается в незначительном количестве. Отсюда необходимость обнаружения свинца во внутренних органах трупов людей, умерших от других причин, и обязательное количественное определения его при положительных результатах качественного анализа.
Естественное содержание свинца (по данным А. О. Войнара, в миллиграммах на 100 г органа) в печени 0,130; в почке 0,027; в трубчатых костях 1,88; в желудке и кишечнике 0,022 и 0,023 соответственно.
Соединения свинца выделяются из организма главным образом с калом. Меньшие количества этих соединений выделяются с желчью, а следовые количества - с мочой. Соединения свинца частично откладываются в костной ткани в виде трехзамещенного фосфата.
Патологоанатомическая картина в острых случаях общая для соединений тяжелых металлов.
Клиническая картина. Острое отравление - головная боль, слабость, головокружение, рвота, брадикардия, артериальная гипотензия, потливость, слюнотечение, зуд, парестезии, тремор конечностей. Симптомы часто развиваются через 6 ч - 2 сут после отравления. При вдыхании паров более выражена неврологическая симптоматика: бессонница, головная боль, атаксия, судороги, галлюцинации, психомоторное возбуждение. При пероральном приеме - диспептические расстройства: жажда, отрыжка, боль в животе, тошнота, рвота, диарея. У детей в течение 1-5 дней - стойкая неукротимая рвота, атаксия, судороги, нарушения сознания.
Хроническое отравление, Возможно возникновение тремора конечностей, повышенной утомляемости, раздражительности, расстройств памяти, бессонницы. Дискомфорт в области живота, рвота, снижение массы тела, гипотрофия мышц. Возможно развитие почечной недостаточности.
Тяжелая интоксикация (острая или хроническая): алиментарный синдром - анорексия, привкус металла (при хронической интоксикации - ощущение волоса) во рту, запоры, кишечные колики, напряжение мышц брюшной стенки (иногда), на дёснах - свинцовая (сине-черная) кайма. Нервно-мышечный синдром (чаще у взрослых): безболезненный периферический неврит и слабость мышц-разгибателей. При хроническом отравлении - свинцовая энцефалопатия (чаще у детей) с эпилептиформными припадками, коматозное состояние; долговременные остаточные явления, включающие неврологические дефекты (нейроциркуляторная триада - артериальная гипотензия, брадикардия, гипотермия), психопатологические расстройства (упорные головные боли, бессонница, повышенная возбудимость, беспокойный сон с кошмарами), задержка умственного развития (у детей). При остром отравлении - галлюцинации, бред, психомоторное возбуждение, маниакальный синдром, судороги.
Беременность. Отравление свинцом во время беременности приводит к рождению недоношенных детей и преждевременному родоразрешению. Свинец обладает тератогенными свойствами.
Исследование осадка
При решении вопроса об отравлении тетраэтилсвинцом (С2Н5)4Рb применяют специальную методику, основанную на изолировании этого яда перегонкой с водяным паром.
Выше было обосновано, что при разбавлении минерализата водой возможно появление мути или выпадение осадка. Это означает, что в минерализате находится белый осадок свинца сульфата. Такого же цвета осадок бария сульфата образуется при отравлении соединениями бария. В результате соосаждения осадки сульфатов свинца и бария могут быть загрязнены ионами кальция, хрома, железа и др. При наличии хрома в осадке он имеет грязно-зеленую окраску. Химико–токсикологический интерес представляют только барий и свинец, которые необходимо до обнаружения разделить.
Оптимальными условиями для количественного осаждения Ва2+ и Рb2+ являются: концентрация в минерализате ~20 % H2SO4, отсутствие окислов азота (частичное растворение PbSО4 и в значительно меньшей степени BaSО4 в кислоте азотной), время осаждения (~24 часа). Вследствие соосаждения в осадке могут также находиться Са2+, Fe3+, Al3+, Cr3+, Zn2+, Cu2+ и др. При соосаждении Сr3+ осадок окрашен в грязно-зеленый цвет. Во избежание потерь Сr3+ грязно-зеленый осадок обрабатывают при нагревании раствором персульфата аммония в 1% растворе серной кислоты. Нерастворившийся осадок подвергают анализу на Ва2+ и Рb2+, а фильтрат оставляют для количественного определения хрома.
Исследование фильтрата на свинец
а) реакцией с дитизоном (H2Dz)
К раствору, содержащему свинца ацетат, прибавляют хлороформный раствор дитизона и взбалтывают. При этом образуется однозамещенный дитизонат свинца Pb(HDz)2, хлороформный раствор которого имеет оранжево-красную окраску:
В зависимости от объема водного слоя раствор исследуют далее микрокристаллическими или макрохимическими реакциями.
При малом объеме водного слоя
а) получают двойную соль йодида цезия и свинца - Cs[PbI3]
(CH3COO)2Pb + CsCl + 3 KI ® Cs[PbI3] ¯ + KCl + 2 CH3COOK
При наличии ионов свинца образуются прозрачные игольчатые кристаллы на жёлтом фоне.
б) образование гексанитрита калия, меди и свинца K2Cu[Pb(NO2)6]
(CH3COO)2Pb + (CH3COO)2Cu + 6 KNO2 ® K2Cu[Pb(NO2)6] ¯ + 4 CH3COOK
Образование чёрных или коричневых кристаллов, имеющих форму куба, указывает на наличие ионов свинца.
При большом объеме водного слоя (2 мл и более)
а) образования PbS:
(CH3COO)2Pb + Na2S = PbS¯ + 2 CH3COO Na
При наличии ионов свинца появляется чёрный осадок.
Осадок не растворяется в разбавленных серной и соляной кислотах, но растворяется в разбавленной кислоте азотной с выделением окислов азота и элементарной серы:
3PbS + 8HNО3 = 3Pb(NО3)2 + 2NO + 3S + 4H2О;
б) образование PbSО4:
(CH3COO)2Pb + H2SO4 ® PbSO4 ¯ + 2 CH3COOH
При наличии ионов свинца появляется белый осадок
Осадок свинца сульфата растворяется в концентрированной серной кислоте с образованием кислой соли:
PbSО4 + H2SО4 = Pb(hso4)2
При добавлении воды вновь выпадает осадок сульфата свинца.
в) образования РbСrО4: нерастворим в уксусной кислоте, но растворим в минеральных кислотах и едких щелочах:
2 (CH3COO)2Pb + K2Cr2O7 + H2O ® 2 PbCrO4 ¯ + 2 CH3COOK + 2 CH3COOH
При наличии ионов свинца появляется оранжево–жёлтый осадок.
г) образования PbI2:
(CH3COO)2Pb + 2 KI ® PbI2 ¯ + 2 CH3COOK
При наличии ионов свинца выпадает жёлтый осадок, который растворяется при нагревании и вновь появляется при охлаждении (в избытке реактива осадок растворяется).
БАРИЙ
Токсикологическое значение
Из соединений бария токсикологическое значение имеют его гидроксид, хлорид, нитрат, карбонат, хлорат и др. Все растворимые соли бария ядовиты. Соединения бария применяю для получения препаратов бария, в керамическом и стекольном производстве (ВаСОз), в текстильной и резиновой промышленности, в сельском хозяйстве (ВаС12) для борьбы с вредителями растений; селенит бария (BaSeО3) и бария карбонат применяют для дератизации. Некоторые препараты бария, например бария хлорид, гидрат окиси бария, имеют применение в аналитических лабораториях. Бария сульфат, применяемый при рентгеноскопии, практически нетоксичен. Смерть наступает от паралича сердца.
В истории отравлений барием различают два периода: первый - до введения бария сульфата в качестве контрастного вещества при рентгенологическом исследовании желудочно-кишечного тракта, второй - после введения бария сульфата в рентгеноскопию. В первом периоде отравления соединениями бария были редкими. Причиной их было применение бария карбоната в смеси с мукой для отравления крыс или бария хлорида для аппретуры белья. С момента внедрения бария сульфата в медицинскую практику отравления солями бария стали встречаться чаще. Причиной этих интоксикаций, как правило, является бария сульфат, нерастворимый в воде и в жидкостях организма, а растворимые соли его, содержащиеся в бария сульфате в виде примесей, или ошибочное применение растворимых солей бария вместо бария сульфата. Известны случаи отравления бария карбонатом, находящимся в бария сульфате в виде примесей. Такие отравления объясняются тем, что для рентгеноскопии используют большие (до 100 г и более) количества бария сульфата, который по способу своего получения может содержать бария карбонат, переходящий в организме под влиянием соляной кислоты желудочного сока в растворимый бария хлорид.
При приеме внутрь ядовитых соединений бария возникают жжение во рту, боли в области желудка, слюнотечение, тошнота, рвота, головокружение, мышечная слабость, одышка, замедление пульса и падение артериального давления. Основной метод лечения отравлений барием - промывание желудка и употребление слабительных средств. Основными источниками поступления бария в организм человека являются пища (особенно морепродукты) и питьевая вода. По рекомендации Всемирной организацией здравоохранения содержание бария в питьевой воде не должно превышать 0,7 мг/л, в России действуют гораздо более жесткие нормы - 0,1 мг/л.
Соединения бария оказываются нейротоксическое (паралитическое), кардиотоксическое, гемотоксическое действия. Основные симптомы: жжение во рту и пищеводе, боли в животе, тошнота, рвота, диарея, головокружение; кожные покровы бледные, покрыты холодным потом. Пульс медленный, слабый; экстрасистолия, мерцание предсердий, возможна остановка сердца; снижение АД; одышка, цианоз. Через 2-3 ч после отравления - нарастающая мышечная слабость (особенно мышц верхних конечностей и шеи), иногда гемолиз.
Соединения бария выделяются из организма главным образом через кишечник. Следовые количества этих соединений выводятся через почки и частично откладываются в костях. Сведения о содержании бария как нормальной составной части клеток и тканей организма в литературе отсутствует.
Патологоанатомическая картина неспецифична: наблюдаются гиперемия и кровоизлияния в слизистой оболочке желудка, кишках, серозных покровах и в легких, жировое перерождение печени. Химико-токсикологическое исследование оказывает серьезную помощь в диагностике отравлений. Выделение бария происходит главным образом через желудочно-кишечный тракт. Ва2+ в незначительных количествах содержится во всех органах и тканях живых существ в качестве естественной составной части организма (А. О. Войнар).
Исследование фильтрата на барий
1. Реакция перекристаллизации BaSО4 из концентрированной кислоты серной.
Часть исследуемого осадка на фильтре переносят на предметное стекло и слегка подсушивают. Затем к осадку прибавляют 2 капли концентрированной кислоты серной и осторожно нагревают до появления паров. (Кислота серная не должна растекаться на предметном стекле). При наличии в осадке бария сульфата на стекле через 15 – 20 мин после охлаждения появляются бесцветные кристаллы, имеющие форму квадратов с вытянутыми углами или в виде мелких крестов и прямоугольных пластинок.
2. Реакция образования бария йодата
BaSO4 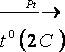 BaS + 2 CO2
BaS + 2 CO2
BaS + 2 HCl ® BaCl2 + H2S
BaCl2 + 2 KIO3 ® Ba(IO3)2 + 2 KCl
На предметное стекло наносят несколько капель 10 % раствора кислоты хлороводородной. Затем платиновой петлёй забирают часть исследуемого осадка и нагревают его в восстановительной части пламени горелки. При этом бария сульфат восстанавливается в бария сульфид, а пламя горелки окрашивается в зелёный цвет.
При исследовании больших количеств осадка и при поступлении на химико–токсикологический анализ химических соединений бария возможно проведение дополнительных подтверждающих реакций.
3. Реакция с калия бихроматом
2 BaCl2 + K2Cr2O7 + H2O  2 BaCrO4 ¯ + 2 KCl + 2 HCl
2 BaCrO4 ¯ + 2 KCl + 2 HCl
Выпадает жёлтый кристаллический осадок.
4. Реакция с кислотой серной
BaCl2 + H2SO4 ® BaSO4 ¯ + 2 HCl
Выпадает белый кристаллический осадок.
5. Реакция с натрия родизонатом
В присутствии катиона бария на бумаге появляется красновато–коричневое пятно не исчезающее от добавления капли кислоты хлороводородной (отличие от стронция).
Объектами исследования на наличие бария могут быть не только органы трупов и биологические жидкости, но и химические соединения этого металла, которые в народном хозяйстве широко используются для борьбы с вредителями сельскохозяйственных культур и для других целей.
Исследование минерализата после отделения осадка
(BaSО4 и PbSО4)
Исследование обычно начинают с Mn2+ и Cr 3+, так как определенное мешающее влияние оказывают Cl-. В основу обнаружения и определения этих катионов положены реакции окисления – восстановления.
МАРГАНЕЦ
Токсикологическое значение марганца. В последние годы соединения марганца приобретают все большее значение в различных областях промышленности: металлургической, стекольной при изготовлении глазури и эмали, химической, ситцепечатании и др. Применяют также некоторые соединения марганца (КМnО4) в медицине и в санитарии.
Соединения марганца являются сильными протоплазматическими ядами, особенно действуют на центральную нервную систему, вызывая в ней тяжелые органические изменения, поражает также почки, органы кровообращения, легкие.
Марганец получил известность главным образом как профессиональный яд. При действии на организм через органы дыхания соединения марганца приводят к тяжелым поражениям центральной нервной системы, а также действуют на почки, органы кровообращения и легкие. Предельно допустимой концентрацией марганца и его соединений в воздухе является 0,0003 мг/л в пересчете на марганец (Н. В. Лазарев).
Острые отравления соединениями марганца нередко приводят к смерти. Причиной смерти были отравления и калия перманганатом, примененным при криминальном аборте.
Смертельная доза калия перманганата для человека точно неустановленна.
По данным А. О. Войнара, при приеме внутрь она составляет 15—20 г.
При вскрытии трупов лиц, погибших в результате отравления калия перманганатом, характерными считаются ожог слизистой оболочки, напоминающий отравление едкими веществами, дегенеративные изменения паренхиматозных органов, главным образом сердца, печени, почек (О. И. Глазова).
При полосканиях, спринцеваниях концентрированными растворами калия перманганата наблюдается отек слизистых оболочек с последующими воспалительными явлениями, приводящими иногда к общему отравлению организма. Независимо oт способа введения марганец выводится из организма через желудочно-кишечный тракт и с мочой. Основным органом, задерживающим марганец, является печень.
Марганец относится к числу широко распространенных элементов, играющих в организме животных определенную биологическую роль. Этим обстоятельством объясняется обязательное обнаружение марганца при судебно-химическом анализе внутренних органов трупа человека. Этим же диктуется необходимость количественного определения при положительных результатах качественного обнаружения его в биологическом материале.
Общее содержание Mn+2 в организме человека доходит до 0,05%; и в экскриментах его содержится 1,8 мг и в печени 0,17- 0,2 мг на 100 г свежего материала.
А.Н. Крылова дробным методом определяла в 100 г печени 0,13 – 0,40 мг естественно содержащегося Mn2+, в почке и матке 0,06 – 0,28 и 0,04 - 0,16мг.
Обнаружение марганца
Обнаружение марганца основано на реакциях окисления Mn2+ до Mn7+ (перманганат–иона), который окрашивает реакционный раствор в цвета от розового до красно–фиолетового в зависимости от концентрации в минерали-зате.
1. Окисление калия перйоодатом
2 MnSO4 + 5 KIO4 + 3 H2O ® 2 HMnO4 + 5 KIO3 + 2 H2SO4
В присутствии марганца появляется окраска от розового до красно -фиолетового цвета.
2. Окислениеи натрия висмутатом
2 Mn(NO3)2 + 5 NaBiO3 + 16 HNO3 ®
® 2 HMnO4 + 5 Bi(NO3)3 + 5 NaNO3 + 7 H2O
В присутствии марганца появляется розовое окрашивание.
3. Окисление аммония персульфатом
2 MnSO4 + 5 (NH4)S2O8 + 8 H2O ® 2 HMnO4 + 5 (NH4)2SO4 + 7 H2SO4
В присутствии марганца появляется розовое окрашивание.
ХРОМ
Токсикологическое значение хрома. Соли хрома широко применяются в различных областях народного хозяйства. Некоторые соединения хрома используются в сельском хозяйстве. В медицине соединения хрома из-за их высокой токсичности в настоящее время не используются.
Наиболее ядовиты хроматы и бихроматы, последние токсичнее хроматов. Соли шестивалентного хрома обладают способностью, действовать раздражающе и прижигающе на кожу и слизистые оболочки, вызывая изъязвления. Типичным признаком является прободение хрящевой части носовой перегородки. В последнее время установлено, что хром обладает канцерогенным действием.
При приемах внутрь наблюдаются ожоги слизистой оболочки рта, пищевода, желудка, припухание, отечность, окрашивание в желтый цвет слизистой полости рта, рвота, иногда кровавая, желтыми или зелеными массами. В литературе имеются разноречивые данные о смертельной дозе солей кислоты хромовой: 0,2 - 0,5 -1 г и даже 8 г (Гадамер). При вскрытии трупов отмечаются явления отравления едкими веществами и желтое окрашивание слизистых оболочек. При острых отравлениях хром накапливается в печени, почках, эндокринных железах.
Хром относится к числу элементов, постоянно обнаруживаемых в организме животных и человека. Описанной выше методикой хром, естественно содержащийся в органах трупа человека, при химико-токсикологическом анализе не обнаруживается.
Обнаружение хрома
При обнаружении хрома, который при минерализации объекта смесью серной и азотной кислот находится в минерализате в основном в степени окисления 3+, его окисляют аммония персульфатом до степени окисления 6+.
В качестве основной реакции используется реакция взаимодействия Cr6+ с дифенилкарбазидом.
1. Реакция с дифенилкарбазидом
Cr2(SO4)3 + 3 (NH4)2S2O8 + 7 H2O  ® H2Cr2O7 + 3 (NH4)2SO4 + 6 H2SO4
® H2Cr2O7 + 3 (NH4)2SO4 + 6 H2SO4
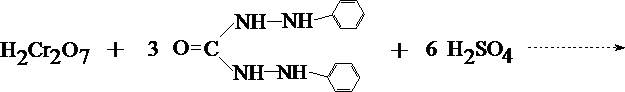
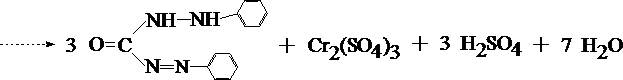


При наличии хрома жидкость в пробирке приобретает красно–фиолетовое окрашивание.
2. Реакция образования надхромовых кислот


В присутствии хрома растворитель окрашивается в сине–голубой цвет.
СЕРЕБРО
Токсикологическое значение имеет лишь серебра нитрат. Он оказывает прижигающее и вяжущее действие на кожу и слизистые оболочки. При длительной работе, как с металлическим серебром, так и с его солями может возникать аргирия (отложение металлического серебра в тканях), проявляющаяся в серо-зеленой до аспидно-серой окраске кожи и слизистых оболочек.
Отравления соединениями серебра большей частью являются случайными, но известны также случаи покушения на самоубийство с помощью серебра нитрата. Проф. А. В. Степанов в руководстве по судебной химии указывает, что предметом судебно-химического исследования неоднократно являлись краски для волос, содержавшие серебро. Соединения серебра при этом способны отчасти восстанавливаться в металлическое серебро, а также, частично разлагая содержащие серу вещества волос, переходить в черный серебра сульфид и обусловливать окраску волос. В качестве окрашивающих растворов применялись раствор серебра нитрата или аммиачный раствор серебра хлорида. Второй жидкостью, ускоряющей окраску, обычно являлся раствор натрия сульфида или аммония.
Серебро довольно широко распространено как в низших, так и в высших животных организмах. По А. О. Войнару, в органах человека обнаруживают в пересчете на 100 г свежих тканей в крови - следы, в мозгу - 0,03 мг, в печени - 0,005 мг, в легких - 0,004 мг, в костях - 0,01 мг серебра.
Естественно содержащееся в органах человека серебро не обнаруживается дробным методом анализа.
Обнаружение серебра
1. Основной реакцией при обнаружении серебра является реакция образования серебра дитизоната.
Для отличия серебра дитизоната от ртути дитизоната окрашенный хлороформный слой обрабатывают при энергичном встряхивании 1 мл 0,5моль/л раствором кислоты хлороводородной. Серебра дитизонат в этих условиях разрушается и золотисто - жёлтая окраска хлороформного слоя переходит в зелёную.
При положительном результате реакции с дитизоном серебро из минерализата выделяют в виде серебра хлорида.
2. Рекция образования серебра хлорида
Ag2SO4 + 2 NaCl ® 2 AgCl ¯ + Na2SO4
При наличии иона сереба образуется белый осадок или муть. Жидкость нагревают до кипения и осадок отделяют фильтрованием после охлаждения,
промывают его один раз водой очищенной и растворяют в 0,5 – 2,5 мл 25 % раствора аммиака.
AgCl + 2 (NH4)OH ® [Ag(NH3)2]Cl + 2 H2O
Аммиачный раствор исследуют следующим образом:
а) Каплю раствора помещают на предметное стекло, дают капле медленно (без нагревания) испариться. При наличии серебра выделяются мелкие прозрачные кристаллы в виде кубов, октаэдров, четырёхугольников. (Смотреть под микроскопом при большом увеличении).
б) К капле исследуемого раствора на предметном стекле прибавляют каплю кислоты азотной разведённой – выпадает белый творожистый осадок серебра хлорида.
[Ag(NH3)2]Cl + 2 HNO3 ® AgCl ¯ + 2 NH4NO3
в) 1 – 2 капли исследуемого раствора упаривают на предмет-ном стекле. На остаток наносят по 1 капле насыщенных растворов тиомочевины и калия пикрата. Образуются жёлтые призматические кристаллы в виде розеток пикрата тиомочевинного комплекса серебра: [AgSC(NH2)2] [C6H2(NO2)3OH].
г) 1 – 2 капли исследуемого раствора помещают на фильтровальную бумагу, на которую ранее была нанесена капля раствора FeSO4. При наличии серебра в центре пятна возникает чёрная окраска Ag (металлическое серебро), а по краям красно–оранжевое кольцо Fe3+.
[Ag(NH3)2]Cl + FeSO4 + H2O ® Ag + Fe(OH)SO4 + NH4Cl + NH3.
ЦИНК
Токсикологическое значение. Различные соединения цинка широко применяются в промышленности, сельском хозяйстве, быту, медицине. Токсикологическое значение имеют главным образом растворимые соли цинка, например цинка хлорид, применяемый в качестве консерванта древесины и входящий в состав так называемой паяльной жидкости, а также цинка фосфид.
Цинка сульфат используется в промышленности в качестве протравы при крашении тканей и в медицине в качестве прижигающего и дезинфицирующего средства. Цинка фосфид применяется в борьбе с грызунами и неоднократно был причиной отравления домашних птиц; отмечены случаи умышленного отравления этим препаратом людей. Известны также случаи «пищевых» отравлений солями цинка вследствие приготовления или хранения пищи, особенно кислой, в оцинкованной посуде.
Смертельных отравлений соединениями цинка (цинка фосфид является исключением) в литературе не описано. Благодаря быстро наступающей рвоте при приемах внутрь солей цинка смертельная, доза сравнительно велика. По Коберту она составляет для цинка хлорида около 5 г.
При остром отравлении солями цинка наблюдаются тошнота, упорная рвота, понос, судороги. Слизистые оболочки полости рта сморщены, белые. При хронических отравлениях среди рабочих, занятых выплавкой латуни, бронзы, разработкой цинковых руд, наблюдается вызываемая вдыханием цинка «цинковая», «латунная» или «литейная» лихорадка, выражающаяся в ряде признаков заболевания и в том числе в приступах озноба и повышении температуры до 37 - 40°.
Цинк, введенный в организм, накапливается в печени и поджелудочной железе. Соли цинка выводятся главным образом через желудочно-кишечный тракт, в меньшей степени - с мочой.
Цинк поступает в организм с пищей. Является широко распространенным элементом как в неживой природе, так и в растительных и животных организмах. В органах человека, по данным А. О. Войнара, наибольшие количества цинка содержатся (в пересчете на 100 г свежего материала) в печени (5,4 -14,5 мг), почках (5,5 мг), волосах (16,3 мг) и костях 10,09 мг.
Дробным методом обнаруживается 2,73 - 6,71 мг естественно содержащегося Zn2+ в 100 г почек и 1,76 - 6,16 мг в 100 г печени, что необходимо учитывать при судебно-медицинской оценке результатов химико-токсикологического анализа.
Обнаружение цинка
При обнаружении цинка вначале проводят реакцию образования цинка дитизоната (основная реакция).
1. Реакция с дитизоном
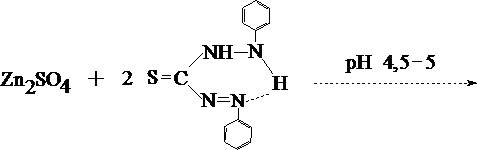

Хлороформный слой окрашивается в розово–фиолетовый цвет.
При положительном результате это реакции на цинк проводят подтверждающие реакции после выделения цинка из минерализата в виде диэтилдитиокарбамината с последующей реэкстракцией 1 моль/л раствором хлороводородной кислоты.


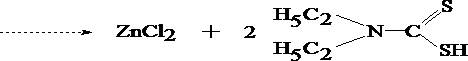
Водное извлечение отделяют, делят на три части и проделывают следующие реакции:
а) Реакция с калия гексацианоферратом (II)
ZnCl2 + K4[Fe(CN)6]  K2Zn3[Fe(CN)6]2 ¯ + 4 KCl
K2Zn3[Fe(CN)6]2 ¯ + 4 KCl
Появляется муть или белый осадок.
б) Реакция образования цинка сульфида
ZnCl2 + H2S  ZnS ¯ + 2 HC
ZnS ¯ + 2 HC
Образуются осадок или муть белого цвета.
в) Реакция с аммония тетрароданомеркуратом
ZnCl2 + (NH4)2 [Hg(SCN)4] ® Zn[Hg(SCN)4] ¯ + 2 NH4Cl
Появляются кристаллы в виде дендритов или одиночных клинообразных кристаллов.
МЕДЬ
Токсикологическое значение. Медь и ее соли широко применяются в промышленности. Для получения красок и в ситцепечатании используются CuO, CuCl2, Cu(NО3)2, СuСО3.Сu(ОН)2 (малахит), Cu(OCOCH3)2, Cu(OCOCH3)2.Cu(OH)2.H2О (ацетат меди основной - ярь-медянка). Сульфат меди CuSО4 применяется, кроме того, в гальванопластике, для пропитки дерева, в производстве чернил; ряд соединений меди используется в сельском хозяйстве в качестве инсектофунгицидов, например CuO, CuCl2, Cu2(OCl)2, CuSО4, CuCО3.Cu(OH)2 (последнее соединение известно под названием препарата АБ). В медицине применяются сульфат меди CuSО4. 5H2О и цитрат меди Си2С6Н4О7. 2,5Н2О.
Токсикологическое значение соединений меди невелико. Смертельной дозой сульфата меди считают 10 г.
Отравления медью в большинстве случаев являются комбинированными (медью и свинцом, медью и цинком и т. п.). При химико-токсикологических исследованиях имеет значение одновременное нахождение в объекте исследования Сu2+ и As2О5 что указывает на возможность отравления швейнфуртской (парижской) зеленью - Cu(OCOCH3)2-3Cu(AsО2)2, зеленью Шееле - Cu2AS2О5 и другими препаратами меди и мышьяка, применявшимися в сельском хозяйстве в качестве инсектофунгицидов. Объектами химико-токсикологического исследования могут оказаться рвотные массы и различные пищевые продукты, в которые медь попадает в результате приготовления пищи в плохо луженой посуде, варки в медном тазу с последующим оставлением в нем охлажденного варенья и т. п.
Широкое распространение меди в природе ведет к нахождению меди во многих растениях, например в семенах бобовых растений; медь находится и в печени, а также во внутренних органах трупов людей, особенно пожилых.
Все это указывает на особую необходимость в случае нахождения меди производить количественное определение, чтобы дать возможность судебно-медицинским экспертам и суду решить, является ли найденная медь естественной составной частью данного объекта, например зеленого горошка, внутренних органов трупа и т. д., или введена умышленно (для окраски консервов или других целей).
А. Н. Крылова определяла дробным методом медь в 100 г печени в пределах 0,56 - 1,12 мг; в почках 0,25 - 0,40 мг и в головном мозге 0,31 - 0,34 мг. Эти количества меди при судебно-медицинской оценки результатов химико – токсикологического анализа должны рассматриваться как естественно содержащиеся количества.
Обнаружение меди
Обнаружение меди основано на избирательной экстракции её из мине-рализата в виде диэтилдитиокарбамината меди с последующей реэкстракцией 1 % раствором сулемы.
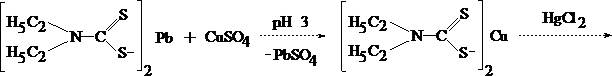
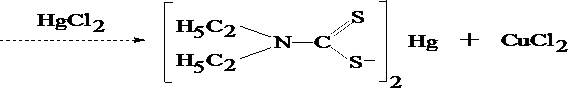
Водный слой отделяют от хлороформа, делят на три части и проделывают следующие подтверждающие реакции:
а) Реакция образования меди цинкатетрародано - меркурата
CuCl2 + 2 (NH4)2[Hg(CNS)4] + ZnSO4 ®
® Cu Zn [Hg(CNS)4]2 ¯ + 2 (NH4)Cl + (NH4)2SO4
В присутствии меди выпавший осадок окрашивается в лилово–розовый цвет.
б) Реакция образования меди - кадмия гексацианоферрата
CuCl2 + CdCl2 + K4[Fe(CN)6] ® Cu Cd [Fe(CN)6] ¯ + 4 KCl
В присутствии меди выпавший осадок окрашивается в сиреневый цвет.
в) Реакция образования пиридинроданидного комплекса меди
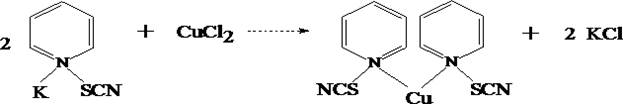
В присутствии меди хлороформ окрашивается в изумрудно–зелёный цвет.
ВИСМУТ
Токсикологическое значение. Металлический висмут применяется в промышленности для получения сплавов с низкой температурой плавления. Соли висмута применяются в фотографии для изготовления косметических мазей и медицинских препаратов [BiOCI, Bi(NО3)s.5H2O, Bi(NО3)3-Bi(OH)3], светящихся со ставов [Bi(NО3)3-5H2О], в производстве хрустального стекла Bi2О3. Медицинскими препаратами висмута являются нитрат основной висмута и органические соединения висмута.
Ядовитыми свойствами обладают легко растворимые соединения висмута, применяемые в терапевтической практике в качестве противосифилитических или рвотных средств. Однако и трудно растворимые соли висмута под влиянием соляной, молочной и других органических кислот образуют легко растворимые комплексные соединения висмута, всасывающиеся в кишечнике. При введении в кровь комплексных солей наблюдались отравления висмутом. Всосавшийся висмут долго задерживается в организме, преимущественно в печени, почках, селезенке, легких, в ткани мозга, и может быть обнаружен в них по прошествии длительных сроков после его введения. Выделение висмута происходит через почки, слизистые оболочки желудочно-кишечного тракта и через потовые железы. Выделяясь потовыми железами, препараты висмута могут вызывать кожный зуд и быть причиной дерматитов.
В следах (цифровые данные в литературе отсутствуют) висмут обнаружен в органах людей как естественно содержащийся элемент.
Дробным методом естественно содержащийся висмут в печени трупа человека не определяется.
Обнаружение висмута
1. Реакция с 8–оксихинолином (основная реакция)
Bi3+ + 4 KI ® [BiI4]– + 4 K+

При добавлении к образовавшемуся осадку 1 мл смеси ацетона и этилацетата (1: 1) и последующем встряхивании осадок растворяется в органическом растворителе, окрашивая последний в цвета от жёлтого до малинового.
2. Реакция с тиомочевинной

При наличии ионов висмута появляется лимонно–жёлтое окрашивание
раствора.
В случае положительного результата этих двух реакций висмут экстрагируют из минерализата в виде ДДТК–висмута.


Хлороформное извлечение отделяют, промывают водой и встряхивают с 1 мл концентрированной кислоты азотной. Азотнокислый реэкстракт отделяют и делят на 2 части, производят реакции:
а) Реакция с цезия хлоридом и калия йодидом (микрокристаллическая) Образуются оранжевые кристаллы в виде многоугольников и шестилучевых звёздCs [BiI4].
б) Реакция с калия бромидом и бруцином (микрокристаллическая)
Образуются зеленоватые игольчатые кристаллы в виде сфероидов.
[C23H26N2O4H] [BiBr4].
КАДМИЙ
Токсикологическое значение. Кадмий широко применяется в различных отраслях промышленности: для получения легкоплавких сплавов, изготовления электродов щелочных аккумуляторов, кадмирования, производства кадмиевых ламп, в фотографии, ювелирном деле. Кадмием заменяют олово для посуды или висмут в типографском шрифте и др.
Металлический кадмий при плавке и окись кадмия ядовиты. Кадмированная посуда может быть источником отравлений вследствие растворимости кадмия в кислых пищевых продуктах. Описаны случаи отравлений как производственного, так и бытового характера.
Соли кадмия, попавшие в желудочно-кишечный тракт, вызывают воспаление почек, жировое перерождение печени и сердца, кишечные кровотечения. Накапливается Cd2+ главным образом в печени и почках.
Смертельная доза солей кадмия, принятых через рот, для человека не установлена.
Предельно допустимая концентрация кадмия в воздухе составляет 0,0001 - 0,0