Цель: изучение колориметрическим методом зависимости скорости от температуры реакции самоокисления-самовосстановления комплексного иона триоксалатомарганцата (111). Определение кинетических характеристик (скорости реакции, константы скорости, порядка реакции, энергии активации).
Посуда и реактивы: компьютер, датчик оптической плотности (525нм), термостатирующее устройство, шприц на 10мл., кювета, магнитная мешалка, мерные колбы на 100мл., мерная пипетка на 10 мл. 0,1М раствор сульфата марганца, 0,1 М раствор щавелевой кислоты, 0,1 М раствор перманганата калия.
Задание: выполните опыты, оформите отчёт.
Правила техники безопасности:
1. Правила работы с реактивами.
2. Правила работы с химической посудой.
3. Правила работы с нагревательными приборами.
4. Правила работы с измерительными приборами.
Методические указания к выполнению лабораторной работы:
Температура оказывает сильное влияние на скорость химических реакций. Например, скорость реакции 2Н2 + 02 = 2Н20 по мере повышения температуры возрастает следующим образом
— при 25°С реакции не происходит;
— при 400°С равновесие устанавливается через 80 дней;
— при 500°С равновесие устанавливается через 2 часа;
— при 600°С происходит взрыв!
Для большинства реакций справедливо эмпирическое правило Вант-Гоффа: при увеличении температуры на каждые 10° скорость реакции возрастает в 2—4 раза. Эта величина называется температурным коэффициентом реакции или коэффициентом Вант- Гоффа и обозначается γ:
Температурный коэффициент скорости реакци и - возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции, числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10°С. 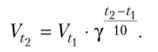 γ= 2-5
γ= 2-5
|
|
Более строго зависимость скорости реакции от температуры описывается уравнением Аррениуса:
{\displaystyle \gamma =(V_{2}/V_{1})^{10/(T_{2}-T_{1})}}
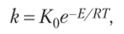 где k — константа скорости;
К0 — предэкспоненциальный множитель (постоянная, не зависящая от температуры); Е — энергия активации; R — газовая постоянная = 8,31;
Т — абсолютная температура, К.
Ход работы:
1. Собирают установку.
2. Поставьте кювету на магнитную мешалку, наденьте на неё датчик оптической плотности и термостатирующее устройство.
3. Налейте в кювету 12.5 мл 0,1м сульфата марганца, 0,1 М щавелевой кислоты и включите магнитную мешалку.
4. Подключите термостатирующее устройство к блоку питания. Блок питания включить в розетку сети.
5. Подключите к компьютеру датчик оптической плотности и термостатирующее устройство.
6. Запускают программу «Химия-практикум»
7. После обнаружения программой термостатирующего устройства, установите температуру термостата на 50 превышающую комнатную температуру (при 20 град. Устанавливается диапазон 24,9 – 25,1 град.)
8. Включите термостат, при этом загорается лампочка – нагреватель. По достижении нужной температуры лампочка выключается.
9. Отберите шприцем 2,5 мл перманганата калия.
10. После обнаружения датчика на экране появится шаблон графика «зависимость оптической плотности от времени». Установите пределы по осям координат:
По абсциссе (Х) – 0-2000 сек.
По ординате (У) – 0-1.
11. Нажать «настройка» в окне эксперимента.
12. После установления температуры в термостате, нажмите кнопку «запустить измерение» и быстро вылейте из шприца в кювету перманганат калия.
13. Когда оптическая плотность достигнет значения «0», нажмите кнопку «остановить измерение».
14. Выключить мешалку и блок питания. Нельзя оставлять включённый термостат вне раствора!
15. Сразу же вылейте содержимое кюветы, промойте её дистиллированной водой и протрите фильтровальной бумагой.
16. Данные все зафиксировать в отчёте.
17. Далее повторите ещё три раза действия пунктов 2-3, 7-9, 11-16. При этом каждый раз устанавливайте в термостате температуру на 100 превышающую предыдущее значение.
Обработка результатов где k — константа скорости;
К0 — предэкспоненциальный множитель (постоянная, не зависящая от температуры); Е — энергия активации; R — газовая постоянная = 8,31;
Т — абсолютная температура, К.
Ход работы:
1. Собирают установку.
2. Поставьте кювету на магнитную мешалку, наденьте на неё датчик оптической плотности и термостатирующее устройство.
3. Налейте в кювету 12.5 мл 0,1м сульфата марганца, 0,1 М щавелевой кислоты и включите магнитную мешалку.
4. Подключите термостатирующее устройство к блоку питания. Блок питания включить в розетку сети.
5. Подключите к компьютеру датчик оптической плотности и термостатирующее устройство.
6. Запускают программу «Химия-практикум»
7. После обнаружения программой термостатирующего устройства, установите температуру термостата на 50 превышающую комнатную температуру (при 20 град. Устанавливается диапазон 24,9 – 25,1 град.)
8. Включите термостат, при этом загорается лампочка – нагреватель. По достижении нужной температуры лампочка выключается.
9. Отберите шприцем 2,5 мл перманганата калия.
10. После обнаружения датчика на экране появится шаблон графика «зависимость оптической плотности от времени». Установите пределы по осям координат:
По абсциссе (Х) – 0-2000 сек.
По ординате (У) – 0-1.
11. Нажать «настройка» в окне эксперимента.
12. После установления температуры в термостате, нажмите кнопку «запустить измерение» и быстро вылейте из шприца в кювету перманганат калия.
13. Когда оптическая плотность достигнет значения «0», нажмите кнопку «остановить измерение».
14. Выключить мешалку и блок питания. Нельзя оставлять включённый термостат вне раствора!
15. Сразу же вылейте содержимое кюветы, промойте её дистиллированной водой и протрите фильтровальной бумагой.
16. Данные все зафиксировать в отчёте.
17. Далее повторите ещё три раза действия пунктов 2-3, 7-9, 11-16. При этом каждый раз устанавливайте в термостате температуру на 100 превышающую предыдущее значение.
Обработка результатов
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лист | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| изм | Лист | № докум | Подп. | Дата | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Таблица 1 Результаты экспериментов
1. Рассчитайте среднее значение температуры для каждого из четырёх опытов, результаты запишите в столбец 2 таблицы 2
2. Постройте общий график зависимости оптической плотности от времени D =f(τ). Взяв 20-25 точек при каждой температуре.
3. Определите начальную скорость реакции для каждой температуры: ʋнач = dD/ dτ = tg α 4. Определите значение константы скорости kт для каждой температуры, как тангенс угла наклона либо прямой kт = ln(D0 / Dτ) / τ = tg α Результаты занести в таблицу 2
5. Постройте два графика для каждой из четырёх температур в координатах А) ln(D0 / Dτ) = f(τ) и б) (D0 - Dτ)/ (D0 *Dτ) = f(τ)
Поиск по сайту©2015-2024 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование. Дата создания страницы: 2021-04-19 Нарушение авторских прав и Нарушение персональных данных |
Поиск по сайту: Читайте также: Деталирование сборочного чертежа Когда производственнику особенно важно наличие гибких производственных мощностей? Собственные движения и пространственные скорости звезд Интересно: |
