канд.вет.наук. Давыдова Наталья Владимировна старший научный сотрудник сектора молекулярной биологии СФНЦА РАН,
Хоменко Юлия Сергеевна младший научный сотрудник сектора молекулярной биологии СФНЦА РАН, ООО «СибАгроТрейд»
Использование методов серологической диагностики инфекционных заболеваний сельскохозяйственной птицы существенно различается для мелких фермерских хозяйств и крупных птицефабрик, промышленного типа. Особенно эти особенности актуальны для птицефабрик бройлерного направления.
Динамика развития гуморального иммунитета у птицы примерно следующая:
• Сывороточные антитела могут быть определены в течение 7-10 дней после вакцинации или первичной инфекции и обычно достигают пикового уровня в период с 14 до 21 дня. Для живых вакцин, часто поствакцинальный иммунитет формируется раньше, для инактивированных – позже, но более напряженный
• Ранние иммуноглобулины класса М появляются через 5 дней после вакцинации и довольно быстро исчезают.
• Поэтому выявление иммуноглобулинов класса М перспективно для диагностики ИЛТ, МПВИ у бройлеров перед убоем и для диагностики любых инфекций у взрослой птицы спустя месяц после последней вакцинации
• Примерно 50% антител передаются от родителей цыплятам, то есть ожидаемые титры в суточном возрасте примерно в два раза меньше
Показатели динамики формирования титров антител весьма важны для взрослой птицы, особенно при диагностике инфекции на основе сероконверисии (прироста титров антител, после переболевания в 3-4 раза). Короткий срок выращивания бройлера затрудняет выявление сероконверсии т.к. прирост титров антител у молодой птицы, перед убоем, наблюдается почти на все инфекции какие имеются на птицефабрике а, применительно для некоторых инфекций, антитела появляются слишком поздно. Для фермерского хозяйства – серомониторинг является. Пожалуй единственным вариантом. Для крупных птицефабрик более надежен ассоциативный анализ – выявление инфекционного агента уровень антител к которому отличается у здоровой и переболевшей птицы или на благополучных и неблагополучных птичниках.
Сам факт выявления присутствия инфекционного агента вирусной или бактериальной природы, в птичнике, на основании обнаружения положительных результатов ИФА, не является основанием для диагностики заболевания и проведения специфических мероприятий. Вирусов и бактерий много на любой птицефабрике и далеко не все из них наносят значимый ущерб. Поэтому основная задача ИФА лаборатории на птицефабрике – своевременная дифференциальная диагностика инфекционного заболевания влияющего на продуктивность или сохранность птицы.
Важным прогностическим критерием неблагополучия может являться неоднородность гуморального иммунитета. Бимодальнойсть кривых распределения титров антител в стаде может говорить о неоднородной вакцинации, неоднородном иммунитете или появлении полевого штамма инфекционного агента. Обычно, при этом, коэффициент вариации начинает превышать 40%. В дальнейшем, коэффициент вариации может резко уменьшиться, когда вся птица переболевает одной и той же инфекцией. Тогда коэффициент вариации может достигать 10-20%, а средний титр антител может превышать нормативные значения для поствакцинального иммунитета. Эти подходы интерпретации ИФА являются общепринятыми.
Сравнение результатов ИФА во взаимосвязи с показателями сохранности трудно реализуемо в мелких фермерских хозяйствах, но весьма эффективно на крупных птицефабриках, где птичников много и можно набрать статистику.
В приведенной таблице есть пример такого анализа. Выявив у цыплят-бройлеров, с ухудшенными показателями сохранности, антитела и к вирусу инфекционной анемии и вирусам ИБК, ИЛТ и МПВИ и возбудителю реовирусной инфекции, мы задались вопросом – какой из имеющихся на птицефабрике вирусов является причиной снижения сохранности?
При ассоциативном анализе, результаты серологических исследований ассоциировались с неблагополучием по сохранности только для инфекционного ляринготрахеита. Благодаря такому подходу удалось исключить негативную роль всех остальных, вышеперечисленных инфекций. Получение этих результатов на бройлере в возрасте 40 дней стало возможным т.к. тестировали иммуноглобулины класса М, которые вырабатываются на 9-10 дней раньше, чем иммуноглобулины класса Y (обычно в ИФА системах тестируют их). Так как ИЛТ вызывает респираторные патологии незадолго до убоя, то эффективна или передержка птицы до 50 дней или использование в ИФА системе коньюгатов к IgM.
Таблица 1. Ассоциативный анализ титров и показателей сохранности-продуктивности. Пример: антитела класса М к вирусу ИЛТ
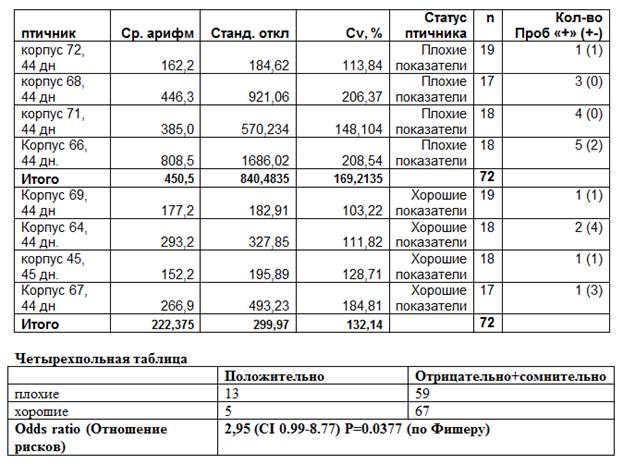
Результаты ИФА по разным птичникам сводили в четырехпольную таблицу, группируя количество серопозитивных и серонегативных сывороток по принципу неблагополучный (плохой) и благополучны (хороший) птичник. Вычисление такого показателя как Odds Ratio (отношение шансов), позволило установить, что наличие серопозитивной, по ИЛТ птицы, повышает риск заболеваемости в 2,95 раза. По другим инфекциям данный показатель был существенно ниже. Статистический анализ позволяет минимизировать риск ложноположительного диагноза по причине случайных статистических колебаний. В данном случае, вероятность того что наш диагноз правилен составила 96,23% (P=0.0377).
Другой пример, снижение привесов на 400 грамм на одной из птицефабрик, что влекло за собой увеличение сроков выращивания и плотности посадки и падение падение сохранности ниже 90-92%, от сопутствующих инфекций
Среди всех найденных инфекций (таблица 2) установлена связь с болезнью Гамборо (только на основании ассоциативного анализа). Оснований ставить такой диагноз по отклонениям титров антител от табличных значений – не было.
Таблица 2. Результаты серологических исследований



IBD – Здоровые ср. титр 1513, CV 44,35 I IBD – Больные ср. титр 1939, СV 14,2%
Рисунок 2. Кривые распределения титров антител к вирус БГ у больной и здоровой птицы в одном и том же птичнике.
Изменение схемы вакцинации против болезни Гамборо, позволило повысить привесы, снизить плотность посадки. Таким образом, точность диагноза была подтверждена опытным путем.
Наиболее актуальны ассоциативные исследования анализы результатов ИФА при болезни Гамборо, вызванной вариантным штаммом БГ ассоциирующимся с провентрикулитами и снижением массы тела у бройлеров и нарушением фосфорно-кальциевого обмена у несушки.
Таблица 3.

Помимо секвенирования, довольно удобен метод оценки авидности антител. Как видно из таблицы 3, авидность антител у птицы пораженной вариантным штаммом БГ закономерно меньше. Связано это с тем, что антитела выработанные к вариантному штамму менее прочно связываются с антигенами классического штамма вируса БГ. Более того, при попадании вариантных штаммов различных вирусов на птицефабрику нельзя уверенно ориентироваться на табличные значения титров при серомониторинге, так как меньшая авидность антител может быть причиной снижения титров у переболевшей птицы (см. рис. 3)
На графике №3 мы видим что рост поражений бурс, желудков, снижения массы тушки сопровождался не повышением средних титров на вирус БГ, а напротив, снижением, в сочетании с ростом коэффициента вариации.

Рис. 3 Динамика изменений средних титров (M + SD) IgM IBD с 14.03.2014 по 12.11.2014 у цыплят-бройлеров на убое в «благополучный» период и при всплеске некротического провентрикулита (Бирнавирус родственный вирусу БГ но поражающий и другие виды птиц, например, попугаев).
Успешная смена вакцинного препарата против БГ на этой, и еще пяти птицефабриках, с аналогичными результатами серологии, также подтвердила правильность сделанных выводов
Разберем статистический аппарат которым можно и нужно пользоваться при анализе результатов серологических исследований на крупных промышленных птицефабриках, на примере ситуации сниженной сохранности от респираторных патологий в предубойном периоде.

Рис. 4 Различия уровней антител (igM) к вирусу МПВИ в птичниках с разным уровнем сохранности
Для серологических исследований была отобрана кровь у бройлеров на убое от пять птичников с наименьшей сохранностью и пяти птичников с наилучшей сохранностью. Обработка результатов серологических исследований показало что ни одна из протестированных инфекций, кроме МПВИ, не показала связи между сохранностью и уровнем антител. Бройлеры прививались против МПВИ инактивированной вакциной в суточном возрасте. Несмотря на то, что такая экзотичная схема вакцинопрофилактики давала неплохие результаты на ряде птицефабрик, на данной птицефабрике была выявлена корреляционная связь между уровнем антител и смертностью. Анализ корреляции между уровнем антител и смертностью, по Спирмену (таблица 4), показал более высокое значение так как этот метод более чувствителен для работы с биологическими объектами.
Таблица 4. Разные варианты статистического анализа результатов ИФА

Весьма информативен такой критерий как отношение шансов - OR (Odds ratio), величина 33 означает что отсутствие антител к МПВИ повышало шанс гибели птицы в 33 раза!!!. Смена вакцины именно против МПВИ, проведение противовирусной терапии позволили улучшить ситуацию на птицефабрике.
Рассмотрим организацию работы ИФА лаборатории на птицефабрике и экономику серологических исследований. Мониторинговые исследвоания наиболее выгодны для коммерческих лабораторных исследований т.к. они подразумевают максимальные расходы ИФА наборов при минимальном их ассортименте и минимальных усилиях по интерпретации. Необходимость отслеживания динамики изменения эпизоотической ситуации по результатам ИФА анализа может решатся и путем одномоментного исследования образцов замороженной сыворотки крови, полученной в разные периоды времени. Стоимость морозильной камеры сопоставима со стоимостью ОДНОГО ИФА набора! При этом, затраты на серомониторинг могут достигать нескольких миллионнов в рублей в месяц. Например – затраты на диагностику причин резкого падения сохранности часто подразумевают 6-12 месяцев на выяснение причин (за это время по очереди проверяются разные гипотезы и по очереди вводятся разные схемы мероприятий) и 0,3-2 млн рублей на серологические исследования (не считая убытков от сниженной сохранности/продуктивности). Этой суммы и времени достаточно для разработки и изготовления прототипа экспериментальной рекомбинантной вакцины на основе антигена гомологичного соответствующему антигену полевого штамма вируса.
Более корректно, на крупных птицефабриках проведение скрининговых исследований (ежеквартально) на все возможные инфекции (для диагностики которых выпускаются ИФА системы). Большую часть сыворотки для ретроспективного анализа динамики эпизоотических процессов лучше хранить в банке сыворотки (морозилке) и при появлении проблем с сохранностью или привесами проводить ассоциативные серологические исследования в отношении 3-5 инфекций сыворотки от 4-5 «плохих» и «хороших» птичников. Мониторинговые исследования следует проводить в последнюю очередь, в основном для контроля смены схем вакцинопрофилактики, смены кросса и т.д.
Заключение. Ввиду того, что значительная часть птицеводческой продукции производится на крупных птицеводческих предприятиях промышленного типа, методы серологической диагностики (на основе серомониторинга) принятые для обслуживания фермерских хозяйств менее эффективны, чем ассоциативные серологические исследования