Медь, серебро и золото образуют оксиды состава 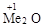 , где они проявляют низшую степень окисления +1, которым соответствуют гидроксиды
, где они проявляют низшую степень окисления +1, которым соответствуют гидроксиды 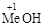 - основания средней силы.
- основания средней силы.
Cu2O - красного цвета
Ag2O - темно-бурого цвета нерастворимы в воде
Au2O - серо-фиолетового цвета
Cu2O и Ag2O взаимодействуют с азотной кислотой и с концентрированными растворами щелочей, т.е. обладают амфотерными свойствами. Растворению малорастворимых соединений этих элементов способствует образование комплексов:
Ag2O + 2HNO3 = 2AgNO3 + H2O
Cu2O + 2NaOH + H2O = 2Na[Cu(OH)2]O(Сu2O) + 4NH3 + H2O ® 2[Ag(NH3)2]OH+ KCl = K[AgCl2]+ 2KCN = K[Ag(CN)2] + KCl+ 2Na2S2O3 = Na3[Ag(S2O3)2] + NaBr
Гидроксид CuOH образуется при действии щелочи на соли Cu+.
AgOH существует в растворе в очень малых концентрациях, т.к. разлагается в момент образования:
AgOH = Ag2O + H2O
Поэтому при действии щелочей на растворы солей серебра (I) образуется оксид Ag2O, а не AgOH:
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O
Соединения серебра (I) - сильные окислители. В реакциях с пероксидом водорода, арсином, альдегидами, иодидом калия и соединениями марганца (II) в растворе аммиака восстанавливается серебро.
Характерным взаимодействием соединений серебра (I) в аммиачных растворах с альдегидами (например, глюкозой) является реакция «серебряного зеркала» (окисление альдегидов до соответствующих кислот или их солей):
2[Ag(NH3)2]OH + R-CHO = 2Ag ¯+ R-CHONH4 + 3NH3 + H2O
Гидроксид золота (I) разлагается с выделением соответствующего оксида:
AuOH = Au2O + H2O
Соединения Cu (I) и Au (I) легко окисляются, даже кислородом воздуха, например
4CuCl + O2 + 4HCl = 4CuCl2+ 2H2O
Соединения CuГ и AuГ (Г - галоген) диспропорционируют:
3AuГ = 2Au + AuГ3
CuI = Cu + CuI2
Соединения элементов со степенью окисления +2 представлены следующими веществами: 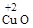 - оксид меди (II) черного цвета; AgF2 и AgO, Ag3(PO4)2, известны комплексы Ag (II).
- оксид меди (II) черного цвета; AgF2 и AgO, Ag3(PO4)2, известны комплексы Ag (II).
Наиболее распространены соединения меди (II), которые являются сильными окислителями. На окислительных свойствах сульфата меди (II) основан процесс дегазации белого фосфора и фосфина:
5CuSO4 + 2P + 8H2O = 5Cu + 2H3PO4 + 5H2SO4
CuSO4 + PH3 + 4H2O = 4Cu + H3PО4 + 4H2SO4
Качественная реакция на соединения меди (II) протекает с альдегидами, например глюкозой, при нагревании с образованием сначала желто-оранжевого осадка гидроксида меди (I), а затем красного осадка Cu2O.
Из соединений с кислородом со степенью окисления +2 устойчивы соединения меди. Оксид CuO нерастворим в воде, но растворим в кислотах.
Гидроксид 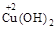 - осадок голубого цвета, образуется при действии щелочей на соли меди (II):
- осадок голубого цвета, образуется при действии щелочей на соли меди (II):
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
Гидроксид меди (II) - неустойчивое соединение, разлагается при нагревании:
Cu(OH)2 = CuO + H2O
Гидроксид меди (II) обладает амфотерными свойствами. Растворим в растворах кислот и щелочей.
В щелочной среде происходит получение гидроксокомплексов:
Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]
С водным раствором аммиака гидроксид меди и оксид меди (II) образуют аммиакат меди (II) сине-фиолетового цвета:
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 + 4NH3 + Н2О = [Cu(NH3)4](OН)2
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
В растворах разбавленных кислот гидроксид меди и оксид меди (II) образуют аквакомплексы:
Cu(OH)2 + 2HCl + H2O = [Cu(H2O)4]Cl2
Соли элементов побочной подгруппы I группы и сильных кислот легко гидролизуются:
Cu(NO3)2 + H2O  CuOHNO3 + HNO3.
CuOHNO3 + HNO3.
Из соединений со степенью окисления +3 известны соединения меди и золота.
При окислении гидроксида меди (II) в щелочной среде гипохлоритом образуется купрат - производное меди (III):
2Cu(OH)2 + NaClO + 2NaOH = 2NaCuO2 + NaCl + 3H2O
Купраты неустойчивы и разлагаются с выделением кислорода в водной среде или при подкислении:
4NaCuO2 + 6H2O = O2 + 4Cu(OH)2 + 4NaOH
NaCuO2 + 12HCl = 4NaCl + 4CuCl2 + O2 + 6H2O
Оксид 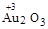 - темно-коричневого цвета порошок, нерастворим в воде, получают косвенным путем. Соответствующий ему гидроксид Au(OH)3 получают при действии концентрированных растворов щелочей на хлорид золота (III) AuCl3:
- темно-коричневого цвета порошок, нерастворим в воде, получают косвенным путем. Соответствующий ему гидроксид Au(OH)3 получают при действии концентрированных растворов щелочей на хлорид золота (III) AuCl3:
AuCl3 + 3NaOH = Au(OH)3 + 3NaCl
Гидроксид золота (III) обладает амфотерными свойствами с преобладанием кислотных свойств. При растворении его в щелочах образуются аураты (соли метазолотой кислоты HAuO2):
Au(OH)3 + KOH = K[Au(OH)4]
При взаимодействии с HCl образуется анионный комплекс:
Au(OH)3 + 4HCl = H[AuCl4] + 3H2O
Гидроксид Au(OH)3 - вещество красно-бурого цвета, при просушивании переходит в желто-красный порошок HAuO2 × H[AuCl4] × 4H2O - золотохлористоводородную кислоту. Образуется при упаривании раствора золота в насыщенной хлором хлороводородной кислоте:
2Au + 3Cl2 + 2HCl = 2H[AuCl4]
Соль этой кислоты Na[AuCl4] × 2H2O называется «золотой» солью.
Ионы золота (III) - сильные окислители:
2AuCl3 + 3SnCl2 + 6HCl = 2Au¯ + 3H2[SnCl6]
AuCl3 + 3H2O2 + 6KOH = 2Au¯ + 3O2 + 6KCl + 6H2O.