Тема. АМИНОКИСЛОТЫ.
Аминокислоты – это органические соединения, которые содержат две функциональные группы: аминогруппу – NH2 и карбоксильную группу – COOH, связанные с углеводородным радикалом.
Строение первого представителя данного класса – аминоуксусной кислоты
СН2 – С = О
| |
NH2 ОН
Классификация аминокислот.
Аминокислоты делят на:
• Природные
Их около 150, они были обнаружены в живых организмах, около 20 из них входят в состав белков. Половина этих аминокислот – незаменимые (не синтезируются в организме человека), поступают с пищей.
• Синтетические
Получают кислотным гидролизом белков, либо из карбоновых кислот, воздействуя на них галогеном, а затем аммиаком.
НОМЕНКЛАТУРА:
Правила тривиальной и систематической номенклатуры
Для названия аминокислот используют три типа номенклатуры – тривиальную, рациональнцю и IUPAC.
По систематической номенклатуре (IUPAC) названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино и указанием места расположения аминогруппы по отношению к карбоксильной группе.
Нумерация углеродной цепи начинается с атома углерода карбоксильной группы.
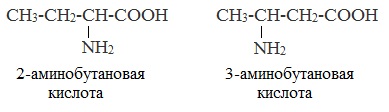
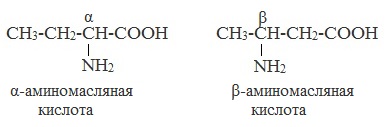
По рациональной еоменклатуре к тривиальному названию карбоновой кислоты добавляется приставка амино с указанием положения аминогруппы буквой греческого алфавита.
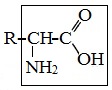
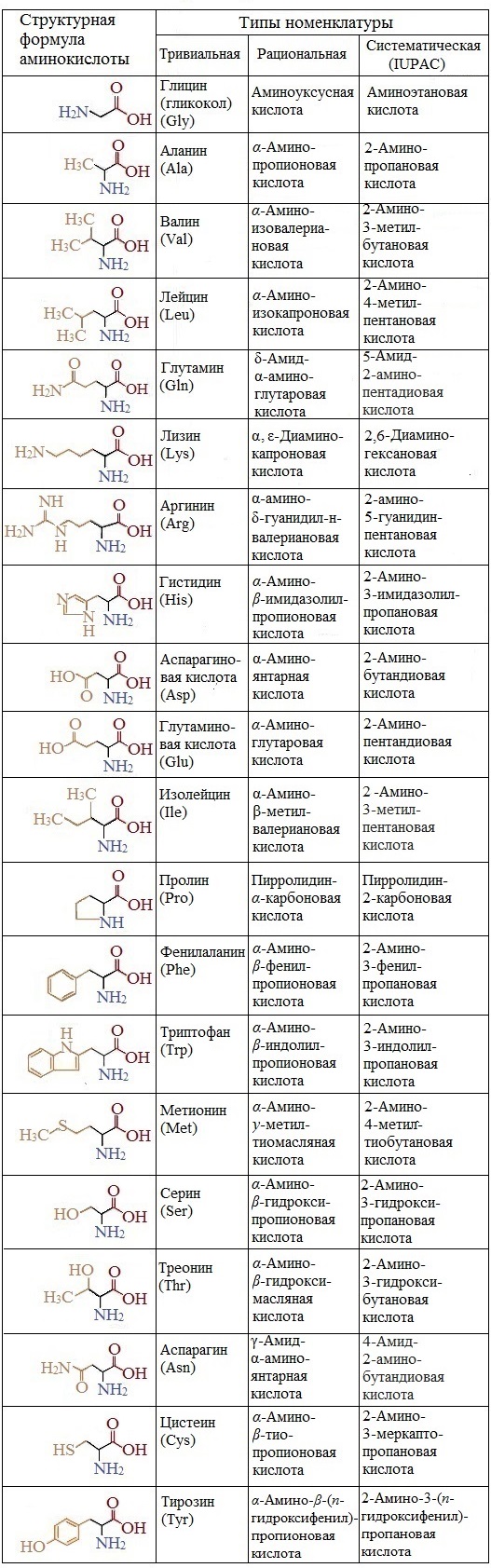
Формулы и названия аминокислот, которые входят в состав белков:
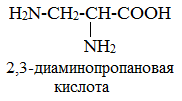
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используют приставку диамино, тир группы – триамино и т.д. наличие двух или трех карбоксильных групп отражается в названии суффиксо –диовая, - триовая кислота.
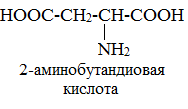
Исторические названия незаменимых аминокислот:
|
|
- ИЗОМЕРИЯ АМИНОКИСЛОТ
1. Изомерия углеводородного скелета
2. Изомерия положения функциональной группы
3. Оптическая изомерия
Оптически активные вещества встречаются в виде пар антиподов-изомеров, физические и химические свойства которых одинаковы, за исключением одного – способности вращать плоскость поляризованного луча в противоположные стороны.
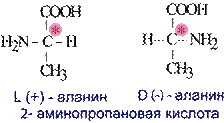 Различают D-аминокислоты и L-аминокислоты.
Различают D-аминокислоты и L-аминокислоты.
Физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запах.
Химические свойства аминокислот.
1) Образование солей это амфотерные соединения, поэтому они способны образовывать соли как с кислотами, так и с основаниями.-. Аминокислоты
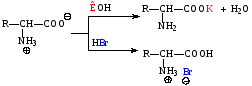
-Аминокислоты способны также образовывать устойчивые комплексные соли с ионами некоторых двухвалентных металлов: Cua2+, Ni2+, Zn2+, Co2+. С ионами Cu2+ получаются кристаллические хелатные соли синего цвета, которые используются для выявления, выделения и очистки аминокислот (качественная реакция).
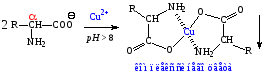
2) Реакции по карбоксильной группе
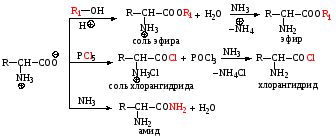
3) Реакции по аминогруппе

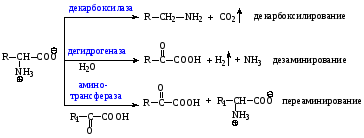
4) Реакции аминокислот под действием ферментов
5. Аминокислоты взаимодействуют друг с другом
NH2 –CH2 –COOH + NH2 –CH2 –COOH → NH2 –CH2 –CO-NH–CH2 –COOH + Н2О
дипептид
-СО–NH – пептидная группа (амидная группа)