Объектами исследование являются таблетки папаверина гидрохлорида «ОАО фармстандарт-томскхимфарм» 10 таблеток по 40мг.
Таблетки белого цвета, плоскоцилиндрические с риской и фаской.
Подлинность. 5мл фильтрата, полученного для количественного определения, переносят в мерную колбу вместимостью 100 мл и доводят объем раствора 0,1 М раствором кислоты хлористоводородной до метки, перемешивают. Ультрафиолетовые спектры поглощения полученного раствора и раствора В РСО папаверина гидрохлорида, приготовленного для определения «растворения», в области от 230 до 270 нм должны иметь максимум при одной и той же длине волны.
20 мл фильтрата, полученного для количественного определения, переносят в мерную колбу вместимостью 50 мл и доводят объем раствора 0,1 М раствором кислоты хлористоводородной до метки, перемешивают. Ультрафиолетовые спектры поглощения полученного раствора и раствора Б РСО папаверина гидрохлорида в области от 270 до 350 нм должны иметь максимумы при одних и тех же длинах волн.
0,1 г порошка растертых таблеток помещают в фарфоровую чашку, смачивают 0,1 мл кислоты азотной концентрированной; появляется желтоватое окрашивание, которое при нагревании на водяной бане переходит в оранжевое.
К 0,2 г порошка растертых таблеток прибавляют 3 мл воды, 1 мл раствора аммиака, взбалтывают и фильтруют через бумажный фильтр. Фильтрат дает характерную реакцию на хлориды:
К 2 мл раствора хлорида (2 – 10 мг хлорид-иона) прибавляют 0,5 мл азотной кислоты разведенной 16 % и 0,5 мл серебра нитрата раствора 2 %; образуется белый творожистый осадок, нерастворимый в азотной кислоте разведенной 16 % и растворимый в аммиака растворе 10 % (ФСП 42-0173-2324-02, ОФС.1.2.2.0001.15).
Средняя масса таблеток. Испытание проводят на 20 единицах дозированной лекарственной формы или содержимом 20 индивидуальных упаковок однодозовых лекарственных форм, отобранных случайным образом.
Методика. Определяют среднюю массу взвешиванием 20 единиц дозированной лекарственной формы или содержимого 20 индивидуальных упаковок однодозовых лекарственных форм: взвешивают каждую единицу в отдельности c точностью до 0,001 г, если не указано иначе в фармакопейной статье или нормативной документации, и рассчитывают среднюю массу.
Требование. Лекарственную форму считают выдержавшей испытание, если не более 2 индивидуальных масс отклоняются от средней массы на величину, превышающую допустимое отклонение, указанное в таблице. При этом ни одна индивидуальная масса не должна отклоняться от средней массы на величину, в 2 раза превышающую значение, указанное в табл. 1 (ОФС.1.4.2.0009.15).
Таблица 1
Допустимые отклонения от средней массы дозированных
лекарственных форм
| Дозированная лекарственная форма | Средняя масса, мг | Допустимое отклонение, % |
| Таблетки без оболочки и таблетки, покрытые пленочной оболочкой | 80 мг и менее | |
| Более 80 мг, но менее 250 мг | 7,5 |
Распадаемость. Испытание предназначено для определения способности таблеток и капсул распадаться в жидкой среде за определенный промежуток времени в условиях, указанных в фармакопейной статье или нормативной документации.
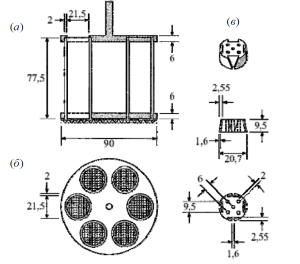
Оборудование. Прибор для определения распадаемости состоит из сборной корзинки, стеклянного сосуда для жидкости вместимостью 1 л, термостатического устройства, поддерживающего температуру жидкости в пределах (37 ± 2) °С, и электромеханического устройства, сообщающего корзинке возвратно-поступательное движение на расстоянии не менее 50 и не более 60 мм в вертикальной плоскости при частоте 28-32 цикла в 1 мин (рис. 1).
Основную часть прибора составляет сборная корзинка с 6 цилиндрическими стеклянными трубками длиной 77,5 ± 2,5 мм с внутренним диаметром 21,85 ± 1,15 мм и толщиной стенки 1,9 ± 0,9 мм. Трубки поддерживаются в вертикальном положении сверху и снизу двумя накладными пластмассовыми пластинами диаметром 90 ± 2 мм, толщиной 6,75 ± 1,75 мм с 6 отверстиями, каждое диаметром 24 ± 2 мм. Отверстия равноудалены от центра пластины и находятся на равном расстоянии друг от друга. К нижней поверхности нижней пластины прикреплена сетка с отверстиями размером 2,0 ± 0,2 мм из нержавеющей стальной проволоки диаметром 0,615 ± 0,045 мм. Пластины удерживаются жестко относительно друг друга вертикальными металлическими стержнями по окружности. Еще один металлический стержень прикреплен к центру верхней пластины, что позволяет прикрепить корзинку к механическому устройству, которое может поднимать и опускать ее. Время, требующееся для движения вверх, равно времени движения вниз; изменение направления движения происходит плавно.
Корзинка движется вертикально вдоль оси. Не должно быть заметного смещения оси в горизонтальной плоскости.
|
В конструкции прибора предусмотрено использование дисков. При этом каждая стеклянная трубка снабжается диском цилиндрической формы диаметром 20,7 ± 0,15 мм и высотой 9,5 ± 0,15 мм (рисунок, в), изготовленным из прозрачной пластмассы с плотностью от 1,18 до 1,20 г/см3. В диске просверлены 5 параллельных отверстий диаметром 2,0 ± 0,1 мм; одно из них расположено в центре диска, остальные 4 – равномерно по кругу радиусом 6,0 ± 0,2 мм от центра диска. На боковой поверхности диска вырезаны 4 выемки трапециевидной симметричной формы, практически перпендикулярные верхней и нижней поверхностям диска. Параллельные стороны выемки совпадают с краями диска и параллельны воображаемой линии, соединяющей два соседних отверстия, расположенных по кругу. Длина параллельной стороны трапеции на нижней поверхности диска составляет 1,6 ± 0,1 мм, выемка имеет форму квадрата. Длина параллельной стороны трапеции на верхней поверхности диска составляет 9,4 ± 0,2 мм и ее середина находится на расстоянии 2,6 ± 0,1 мм от окружности диска. Все поверхности диска гладкие.
Применение дисков оговаривается в фармакопейной статье или нормативной документации.
Корзинку помещают в стакан, высота которого составляет 149 ± 11 мм, внутренний диаметр – 106 ± 9 мм. Объем жидкости должен быть таким, чтобы при подъеме корзинки в крайнее верхнее положение сетка находилась ниже поверхности жидкости не менее чем на 15 мм, а при опускании корзинки в крайнее нижнее положение – на 25 мм выше дна сосуда, и верхние открытые концы стеклянных трубок – над поверхностью жидкости.
Конструкция корзинки может изменяться при условии соблюдения указанных выше требований для стеклянных трубок и проволочной сетки.
Методика. Для проведения испытания отбирают 18 образцов таблеток (или капсул), если нет других указаний в фармакопейной статье или нормативной документации. В каждую из 6 трубок помещают по одному образцу и, если предписано, диск. Опускают корзинку в сосуд с жидкостью, указанной в фармакопейной статье или нормативной документации, и включают прибор. По истечении установленного времени корзинку вынимают и исследуют состояние таблеток и капсул. Все образцы должны полностью распасться. Если 1 или 2 образца не распались, повторяют испытание на оставшихся 12 образцах. Не менее 16 из 18 образцов должны полностью распасться.
Интерпретация результатов. Образец считается полностью распавшимся, когда кроме фрагментов нерастворимой оболочки таблетки (капсулы), находящихся на сетке или прилипших к нижней поверхности диска, если использовались диски, нет никакого остатка или остаток представляет собой мягкую массу, которая разрушается при легком прикосновении стеклянной палочки. Наличие такого остатка должно быть оговорено в фармакопейной статье или нормативной документации (ОФС.1.4.2.0013.15).
Растворение. Испытание «Растворение» предназначено для определения количества действующего вещества, которое в условиях, указанных в фармакопейной статье или нормативной документации, за определенный промежуток времени должно высвобождаться в среду растворения из твердой дозированной лекарственной формы.
В фармакопейной статье или нормативной документации на конкретную твердую дозированную лекарственную форму указывают:
§ тип аппарата;
§ среду растворения – состав и объем;
§ скорость вращения мешалки для аппаратов I и II или скорость потока среды растворения для аппарата III;
§ время отбора проб;
§ аналитический метод количественного определения действующего вещества или действующих веществ, высвободившихся в среду растворения;
§ количество действующего вещества, которое должно высвободиться в среду растворения за нормируемое время, выраженное в процентах от заявленного содержания.
Испытание «Растворение» проводится при контроле качества лекарственной формы для подтверждения постоянства ее свойств и надлежащих условий производственного процесса.
Испытание «Растворение» для многокомпонентных твердых дозированных лекарственных форм допускается проводить по наименее растворимому действующему веществу.
Аппарат I «Вращающаяся корзинка»
Аппарат I (рис. 2) состоит из:
— сосуда для растворения (В) с полусферическим дном, изготовленного из боросиликатного стекла или другого подходящего прозрачного инертного материала. Номинальная вместимость сосуда для растворения составляет 1000 мл; высота – 185 ± 25 мм; внутренний диаметр – 102 ± 4 мм;
— двигателя с регулятором скорости, поддерживающим скорость вращения корзинки в пределах ±4 % от скорости вращения корзинки, указанной в фармакопейной статье или нормативной документации;
– перемешивающего элемента, который состоит из вертикального вала (А), к нижней части которого прикреплена цилиндрическая корзинка (Б). Ось вращения вала не должна отклоняться от вертикальной оси сосуда более чем на 2 мм. Вращение вала должно быть плавным, без существенных колебаний.
Корзинка состоит из двух частей: верхняя часть, имеющая отверстие диаметром 2,0 ± 0,5 мм, должна быть приварена к валу и снабжена 3 упругими зажимами или другим подходящим приспособлением, позволяющим удалять нижнюю часть корзинки для введения испытуемого лекарственного средства. Съемная часть корзинки сделана из сваренной прямым швом металлической проволочной сетки, в которой проволока диаметром 0,21-0,31 мм образует отверстия размером 0,36-0,44 мм. Сетка имеет форму цилиндра и сверху и снизу ограничена металлической оправой.
При использовании агрессивных кислых растворов может использоваться корзинка, покрытая слоем золота толщиной 2,5 мкм.
Расстояние между дном сосуда для растворения и корзинкой должно составлять от 23 до 27 мм.
Для предотвращения испарения среды растворения сосуды для растворения должны закрываться крышками с центральным отверстием для прохождения оси корзинки, а также с отверстиями для термометра и отбора проб.
Для поддержания температуры среды растворения (37 ± 0,5) °С аппарат должен быть оснащен водяной баней с постоянным объемом термостатируемой жидкости.
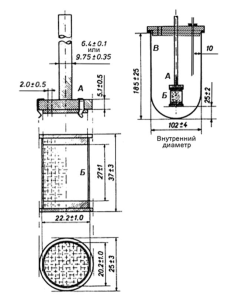
Рисунок 2. Аппарат I «Вращающаяся корзинка»
Условия испытания: среда растворения – вода, объем – 900 мл, скорость вращения корзинки – 100 об/мин, время растворения – 45 мин.
2 мл фильтрата помещают в мерную колбу вместимостью 25 мл, доводят объем раствора 0,1 М раствором кислоты хлористоводородной до метки и перемешивают.
Измеряют оптическую плотность полученного раствора на спектрофотометре в максимуме поглощения при длине волны 250 нм в кювете с толщиной слоя 10 мм.
Параллельно измеряют оптическую плотность раствора В РСО папаверина гидрохлорида.
В качестве раствора сравнения используют 0,1 М раствор кислоты хлористоводородной.
Количество папаверина гидрохлорида, перешедшего в раствор в процентах (X) вычисляют по формуле:
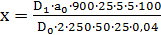 =
= 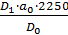
где D1 – оптическая плотность испытуемого раствора;
D0 - оптическая плотность раствора В РСО папаверина гидрохлорида;
a0 – навеска РСО папаверина гидрохлорида в граммах.
В раствор через 45 мин должно перейти не менее 70% (Q) папаверина гидрохлорида.
Примечание. Приготовление раствора РСО папаверина гидрохлорида. Около 0,05 г (точная навеска) папаверина гидрохлорида растворяют в мерной колбе вместимостью 250 мл в 0,1 М растворе кислоты хлористоводородной и доводят объем раствора тем же раствором до метки (раствор А).
Срок годности раствора А 1 мес при хранении в защищенном от света месте.
5 мл раствора А помещают в мерную колбу вместимостью 50 мл, доводят объем раствора 0,1 М раствором кислоты хлористоводородной до метки (раствор Б).
1 мл раствора Б содержит около 0,00002 г папаверина гидрохлорида.
5 мл раствора Б помещают в мерную колбу вместимостью 25 мл и доводят объем раствора 0,1 М раствором кислоты хлористоводородной до метки (Раствор В).
1 мл раствора В содержит около 0,000004 г папаверина гидрохлорида.
Растворы Б и В используют свежеприготовленными (ОФС.1.4.2.0014.15).
Посторонние примеси. 1 г порошка растертых таблеток растворяют в 5 мл хлороформа и фильтруют (раствор А). 1 мл раствора А помещают в мерную колбу вместимостью 100 мл, доводят объем раствора хлороформом до метки и перемешивают (раствор Б).
На линию старта пластинки Сорбифил УФ 254 размером 5 х 15 см наносят 0,01 мл раствора А (около 230 мкг папаверина гидрохлорида). Рядом, в качестве свидетелей, наносят 0,01 мо (около 2,3 мкг) и 0,002 мл (0,5мкг папаверина гидрохлорида) раствора Б. Пластинку с нанесенными пробами сушат на воздухе в течение 5 мин, затем помещают в камеру со смесью толуол – этилацетат – диэтиламин (7:2:1) и хроматографируют восходящим методом. Когда фронт подвижной фазы пройдет расстояние 10 см, пластинку вынимают из камеры, сушат на воздухе в течение 20 мин и просматривают в УФ – свете при длине волны 254 нм. Содержание примеси оценивают сравнением по совокупности величины и интенсивности поглощения пятен на хроматограмме препарата с пятнами на хроматограмме свидетеля (2,3 мкг).
На хроматограмме препарата допускается только одно пятно примеси (не более 1%). Пятна по линии старта во внимание не примимают.
Результаты анализа считаются достоверными, если выполняется требования теста «Проверка пригодности хроматографической системы».
Примечание. Проверка пригодности хроматографической системы. Хроматографическая система считается пригодной, если на хроматограмме свидетеля (0,5 мкг) четко видно пятно (ОФС.1.2.1.2.0003.15).
Количественное определение. Около 0,17 г (точная навеска) порошка растертых таблеток растворяют в мерной колбе вместимостью 250 мл в 0,1 М растворе кислоты хлористоводородной и доводят объем раствора той же кислотой до метки. Раствор фильтруют через бумажный фильтр, отбрасывают первые 15 мл фильтрата.
10 мл фильтрата переносят в мерную колбу вместимостью 50мл и доводят объем раствора 0,1 М раствором кислоты хлористоводородной до метки.
Измеряют оптическую плотность полученного раствора на спектрофотометре в максимуме поглощения при длине волны 310 нм в кювете с толщиной слоя 10 мм.
Параллельно измеряют оптическую плотность раствора Б РСО папаверина гидрохлорида.
В качестве раствора сравнения используют 0,1 М раствор кислоты хлористоводородной. Содержание папаверина гидрохлорида в одной таблетке в граммах (X) вычисляют по формуле:
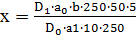 =
= 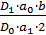
где D1 – оптическая плотность испытуемого раствора;
D0 – оптическая плотность раствора Б РСО папаверина гидрохлорида;
a1 – навеска препарата в граммах;
a0 – навеска РСО папаверина гидрохлорида в граммах;
b – средняя масса таблетки в граммах.
Содержание C20H21NO4 ∙ HCl (папаверина гидрохлорида) должно быть от 0,037 до 0,043 г, считая на среднюю массу одной таблетки.