Переработка ТПО и БО, которые нельзя или нецелесообразно подвергать сепарации по группам способом высокотемпературной переработки
Как видно из изложенного в пятой главе материала значительная часть (по весу) ТБО может и должна перерабатываться способом экологической биотехнологии. Другая фракция ТБО, включая стекло, железо, пластмассы и другие виды ТБО также должны перерабатываться в товарные продукты так, как это было изложено в предыдущих главах, посвященных переработке ТПО для каждого вида сырья. Так в частности стеклобой следует направлять на переплавку. Железо и другие металлы также на переплавку. Пластические массы на повторную переработку. Способ переработки этого вида сырья уже излагался в предыдущих главах. Однако есть некоторые особенности при повторной переработке синтетических полимерных материалов. Особенно это касается переработки синтетических смол и пластических масс, содержащих ароматическое ядро и продуктов, которые при переработке при относительно высокой температуре +100-+800°С могли бы выделять галоиды: хлор и/ или бром. Суть этого заключается в том, что при переработке такого синтетического полимера, а также сложного эфира целлюлозы, полученного в среде мелиленхлорида могут в присутствии даже следов галоидов хлора и брома образовываться галоидированные ДО и ДПВ по упомянутой уже во второй главе схеме и повторенной сейчас, а именно.
Пиролиз и хлорирование (бромирование) природных предшественников (1):
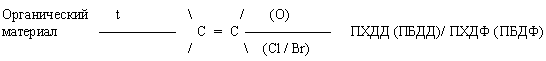
В результате образуется типичный галоидированный ДО и ДПВ - полихлордибензодиоксин (полибромдибензодиоксин) и/ или полихлордибензофуран (полибромдибензофуран).

То есть по классификации Л.А. Федорова образуется III, IV, V и VI представитель галоидированных ДО и ДПВ (1). А это страшно и сверхопасно. Кроме того, следует заметить, что в небольших поселках, в небольших городах сепарацию ТБО по видам не целесообразно проводить по технико-экономическим соображениям. Как же поступать с такими видами ТБО, образующихся в сравнительно небольших количествах? Кроме того, как поступать с определенными видами ТПО ряда металлоперерабатывающих производств? Как обходиться, как использовать отработанные химические источники тока (ОХИТ)? И, наконец, куда девать отходы хирургии, стоматологии и т.п.?
Итак, все эти перечисленные виды ТПО и ТБО, а также отходы лечебных учреждений в виду их высокой в первую очередь инфекционной опасности на наш взгляд подлежат высокотемпературной переработке при температуре +1200-+1600°С в течение не менее 4-7 часов производственного цикла для полной стерилизации биологических отходов и полной дегазации супертоксикантов ДО и ДПВ, которые могут существовать в этих видах отходов в качестве побочных продуктов или даже в следах. При таких температурах все компоненты переходят в состояние близкое к плазменному. Для переработки этой категории ТПО и ТБО следует применять технологический процесс "Пурвокс" (2) или электротермический реактор (3), который, как будем надеяться, будет выпускаться в промышленных условиях с разным объемом загрузки и с разной производительностью. На наш взгляд электротермический реактор будет несомненно дешевле при серийном производстве, чем аппарат для проведения технологического процесса "Пурвокс".
Высокотемпературная переработка ТП и ТБО - гарантия уничтожения всех видов биологических, биохимических продуктов и канцерогенов-супертоксикантов
При загрузке отходов металлоперерабатывающих производств, синтетических полимерных материалов неизвестной химической природы (возможно содержащих в макромолекулярной цепи ароматические кольца, например, полиэтилентерефталата и галоидированных полиолефинов, например, поливинилхлорида), отработанных химических источников тока (ОХИТ), остатков смазочно-охлаждающей жидкости (сож) после металлообработки, хирургических, стоматологических и других биологических отходов лечебных и научно-исследовательских организаций и учреждений и не сепарированных ТБО постепенно в течение нескольких часов необратимо происходит разрушение галоидированных ДО и ДПВ по схеме:

Наиболее опасные компоненты ОХИТ также разлагаются и протекает ряд процессов (4):
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl+H2O+Mn2O3.....(I)
Zn+2NH4Cl+1/2O2=Zn(NH3)2Cl2+H2O......(II)
Zn+NaOH+1/2O2=NaHZnO2......(III)
Zn+CuO+NaOH=Zn(ONa)2+Cu+H2O......(IV)
HgO+Zn+2KOH=Hg+K2ZnO2+H2O......(V)
PbO2+H2SO4+Zn=PbSO4+ZnSO4+2H2O.......(VI)
PbO2+2H2SO4+Cd=PbSO4+CdSO4+2H2O......(VII)
PbO2+4HClO4+Pb=2Pb(ClO4)2+2H2O......(VIII)
Ag2O+4KOH+Zn=2Ag+K2ZnO2+H2O......(IX)
Cu2Cl2+Mg=2Cu+МgCl2......(X)
2AgCl+Mg=2Mg+MgCl2.....(XI)
6Mg+8H2O+C6H4(NO2)2=C6H4(NH2)2+6Mg(OH)2.....(XII)
Mg+H2O+2MnO2=Mn2O3+Mg(OH)2......(XIII)
Итак, в начале процесса термообработки все эти компоненты, приведенные в уравнениях (I) - (XIII) постепенно переходят по мере нагревания массы в жидкое и далее в состояние, близкое к плазменному. В электротермическом генераторе (ЭТГ), где количественно преобладает углерод (С) в виде графита и чугун в виде элементарного Fe (при больших загрузках ТПО металлоперерабатывающих производств) до его окислов FeO, Fe2O, вода поступающая в реактор переходит в парообразное состояние. Протекают процессы:
H2O+C  H2+CO.........(XIV)...........(5)
H2+CO.........(XIV)...........(5)
То есть образуется водяной газ. При наличии паров воды, кроме того происходит процесс:

При этом следует заметить, что в верхней части реактора, где температура ниже преобладает процесс  с образованием CO2 и H2. В нижней части реактора, где преобладает более высокая температура преобладают процессы и образуются продукты СО+Н2О. При этом СО оксид углерода образуется при очень высоких температурах, когда диоксид углерода СО2 неустойчив (6). Процесс образования водяного газа эндотермичен, поэтому углерод охлаждается. Однако, поскольку в реакторе температура t>+1000°С происходит процесс (6):
с образованием CO2 и H2. В нижней части реактора, где преобладает более высокая температура преобладают процессы и образуются продукты СО+Н2О. При этом СО оксид углерода образуется при очень высоких температурах, когда диоксид углерода СО2 неустойчив (6). Процесс образования водяного газа эндотермичен, поэтому углерод охлаждается. Однако, поскольку в реакторе температура t>+1000°С происходит процесс (6):

Процессы (XVI) и (XVIа) протекают при взаимодействии воздуха с раскаленным углеродом. В результате получается смесь СО+N2, т.е. образуется генераторный газ. В итоге в отходящих газах из реактора содержится водяной газ: СО+Н2 и генераторный газ СО+N2. Синтез аммиака из газообразных N2 и Н2 не происходит, т.к. этот процесс может происходить при низких температурах и при высоком давлении (7). При высоких температурах происходит разложение ОХИТ:
Q+NH4Cl  NH3+HCl...........(XVII) (7)
NH3+HCl...........(XVII) (7)
Разложение Zn (NH3)2Cl2 происходит при его плавлении при нагревании по схеме:
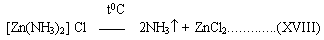
Аналогично разрушается комплекс:
[Hg(NH3)2]Cl2..................
ZnCl2 в таких условиях выкипает (8). Однако по мере выхода из реактора ZnCl2 оседает (конденсируется) на сравнительно холодных поверхностях трубопроводов.
Синтез синильной кислоты HCN сильнейшего яда в данных условиях маловероятен, т.к. он происходит хотя и при нагревании до температуры t>+500-+600°С, но в присутствии особых катализаторов (диоксида церия СеО2 (6) или в присутствии диоксида тория ThO2 (7)):

Ни того, ни другого катализатора у нас в системе нет. Кроме того, рабочая температура процесса значительно больше +500-+600°С.
Кроме того, возможно протекание следующих процессов:

ZnO при +1950° возгоняется при более высокой температуре, разлагается до Zn и O2 (8):
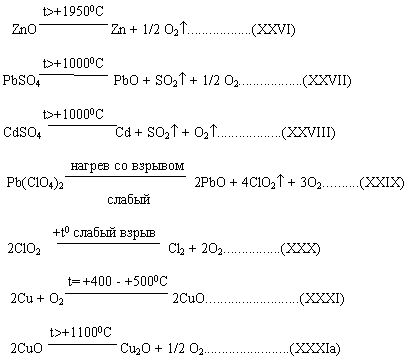
Хлористый магний MgCl2 сначала плавится при t=+718°С, затем при t=+1412°С кипит.
"Кальцинированная" сода, входящая в состав сож разлагается:

При высокотемпературной обработке ТБО образуются следующие вещества:

Вполне естественно из не сепарированных ТБО токсичных веществ не образуется, если не считать SO2, который может образоваться из ТБО (за счет термического разложения меркантанов). Из СОЖ продуктами газогенерации могут быть:

Таким образом при высокотемпературной переработке не сепарированных ТБО, остатков СОЖ продуктами газогенерации являются следующие компоненты:
1. Так называемый генераторный газ: CO+N2;
2. Так называемый водяной газ: СО+Н2.
В процессе электротермического воздействия на ОХИТ происходит также разложение фенилендиамина C6H4(NH2) до CO; CO2; N2 и H2. В кубовых остатках, в шлаке остается большой комплекс веществ, а именно:
1. Железо и небольшое количество окислов его. Эти вещества составляют (в зависимости от соотношения загружаемых компонентов) значительную часть, возможно до 70-90% от общей массы шлака. В шлаке также должно содержаться небольшое количество MgSiO3 и CaSiO3 из ТБО, CuO и Cu2O; PbO; очень немного ZnCl2; Cd (почти в следах); MgO; Mn3O4 (Mn3O4 синтезируется по реакции:

2. Кроме того в шлаке могут содержаться MgCl2 (частично выкипает при t=+1412°С) в следах NaOH; KOH; в следах Ag и AgCl (AgCl кипит при t=+1550°С)(8) и Hg.
Продукты, которые образуются при разложении ОХИТ следующие:

Все возгоняющиеся продукты практически осаждаются на трубах в процессе охлаждения выделяющейся массы газагенератов и возгоняющихся веществ не доходят до барботеров-поглотителей. Таким образом, в тоже время при электротермической обработке всех ранее упомянутых отходов (отходов металло-перерабатывающих производств, несепари-рованных ТБО, ОХИТ, остатков СОЖ и биообъектов) между газообразными продуктами могут происходить следующие процессы:
SO2 + Cl2 = SO2Cl2..................(XXXIII).......(6)
SO2Cl2 + 2H2O = H2SO4 + 2HCl..............(XXXIIIa)..........(6)
нагрев
Cl2 + H2O + Q = HCl + HClO...........(XXXIV).......(7)
HCl + aq = HCl. aq + Q.................(XXXIVa)........(7)
CO + Cl2 = COCl2.....................(XXXV)..............(6) (7)
Таким образом возможно образование оксохлорида углерода или фосгена. Под воздействием паров воды фосген медленно гидролизуется:
COCl2 + 2H2O ---- 2HCl + H2CO3.................(XXXVa)........(6) (7)
Самыми нежелательными процессами являются следующие:
1. Образование хлора;
2. Образование хлористого сульфурила;
3. Образование оксохлорида углерода (фосгена).
Как подавить эти процессы? Самое реальное в наших условиях обильное орошение синтез-газа водой или даже барботирование синтез-газа через слой воды в барботерах так, чтобы в максимальной степени протекали процессы поглощения вредных газообразных веществ водой, а именно процессы (XXXIIIa), (XXXIV), (XXXIVa), (XXXVa). Тем не менее, чтобы полностью обезопасить течение процесса и исключить выброс в отходящих газах Cl2; SO2Cl2; COCl2 следует предусмотреть вторую и третью степень барботирования синтез-газа водой для полного поглощения вредных газов и протекания вышеупомянутых процессов на 100%. Кроме того, предлагается при вышеупомянутой загрузке отходов производить минимальную загрузку ОХИТ, которые являются самыми экологически опасными компонентами - генераторами хлора со всеми вытекающими последствиями в том числе и с возможностью образования галоидированных ДО и ДПВ.
Для разделения разбавленных кислот предлагаются следующие приемы:
После проведения каждой технологической операции производить анализ жидкости из соответствующих емкостей на наличие:
а) серной кислоты, H2SO4 на первых порах качественно введением водного раствора BaCl2 и наблюдением выпадения белого творожистого осадка BaSO4 по реакции: H2SO4+BaCl2=BaSO4 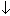 +2HCl............(XXXVI)
+2HCl............(XXXVI)
и количественно по наличию сульфат-иона SO4--;
б) соляной кислоты HCl сначала качественно введением водного раствора AgNO3 и выпадением белого осадка AgCl по реакции:
HCl+AgNO3=AgCl+HNO3.................(XXXVII)
а затем количественно по наличию хлор иона;
в) угольной кислоты H2CO3 качественно введением BaCl2 или введением Ca(OH)2 и образованием осадков по реакциям:
BaCl2+H2CO3=BaCO3 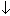 +2HCl..................(XXXVIII)
+2HCl..................(XXXVIII)
H2CO3+Ca(OH)2=CaCO3 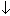 +H2O
+H2O
и количественно по наличию карбоний0иона.
В принципе возможны накладки всех процессов друг на друга. Это конечно может осложнить разделение кислот. Во всяком случае при введении BaCl2 могут происходить оба процесса (XXXVI) и (XXXVIII), т.е. могут осаждаться BaSO4 и BaCO3. Таким образом, применяя одни и те же реагенты можно жидкость из соответствующих емкостей (из поглотителей) подачей водного раствора BaCl2 перевести в технически слабый водный раствор соляной кислоты HCl.
Итак, рассмотрим один из прогнозируемых вариантов технологии переработки ТП и БО в электротермическом реакторе (ЭТР).
6.2. Прогнозируемая технология переработки ТП и БО в электротермическом реакторе (ЭТР) (один из возможных вариантов)
Для соблюдения правил техники безопасности конструктивно предусматривается наличие предохранительного клапана для возможного сброса максимального давления в I и II камерах ЭТР.
Для переработки ТП и БО в ЭТР, как уже упоминалось используются следующие виды отходов:
1. ТО лечебных и научно-исследовательских организаций и учреждений (включая использованные бинты, тампоны, отходы хирургии и стоматологии и т.п.), т.е. ТО, содержащие остатки различных a-аминокислот: 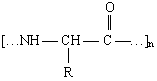 где R - CH3; C2H5; CH2C6H5 и т.д. и [С6H7O2(OH)3]n
где R - CH3; C2H5; CH2C6H5 и т.д. и [С6H7O2(OH)3]n
2. Синтетические высоко-, олиго- и низкомолекулярные органические вещества, содержащие хлор или бром (в том числе галоидированные полиолефины), а также природные высокомолекулярные полимеры (в том числе целлюлозосодержащие материалы, подвергнутые в процессе облагораживания отбелке хлорсодержащими компонентами):

3. Отработанные химические источники тока (ОХИТ) - смесь различных неорганических и некоторых органических (C6H4(NH2)2 и (C6H4(NO2)2) веществ в том числе хлорсодержащих;
4. Смазочные охлаждающие жидкости (СОЖ) с отходами черных и цветных металлов.
При переработке ОХИТ они загружаются, как уже упоминалось, в минимальных количествах в ЭТР.
Для переработки ТП и БО предусматриваются следующие температурные режимы в камерах ЭТР:
I камера
В нижней зоне t > +1200 - +1600°С
В средней зоне tmax >+1200 - +1400°C
В верхней зоне tmax  +500 - +800°С
+500 - +800°С
II камера
В нижней зоне t > +1200 - +1400°С
В средней зоне t  +1000 - +1200°C
+1000 - +1200°C
В верхней зоне t  +300 - +400°C
+300 - +400°C
Описание технологического процесса
В зависимости от объема электротермического реактора (ЭТР) в него загружаются в соответствующих количествах ТП и БО, производится постепенный разогрев камер и в соответствии с временным технологическим регламентом подается вода. Начинается течение технологического процесса в соответствии с регламентом. По мере протекания технологического процесса в соответствии с одним из прогнозируемых вариантов химико-технологического процесса начинается процесс газовыделения и образования одного из основных продуктов газогенерации - синтез-газа. Одновременно в соответствии с регламентом предусматривается абсорбция вредных и очень токсичных примесей в тарельчатых колоннах со сливными устройствами, изображенных на рис. 14.
Рис. 14. Тарельчатая колонна со сливными устройствами для поглощения вредных газов (в разрезе): 1 - тарелка; 2 - сливное устройство.
По мере абсорбции в тарельчатых колоннах (см. рис. 14 и рис. 15) поз. 1,2,3 (см. рис. 15) образуется смесь слабых минеральных кислот (H2SO4; HCl; H2CO3), которые в соответствии с регламентом подаются в накопительные сборники поз. 4,5,6. Далее, по мере заполнения накопителей, смесь кислот подается в аппарат поз.7 (рис. 15), куда в
Рис. 15. Технологическая схема работы электротермического реактора ЭТР с установкой по улавливанию токсичных выбросов (один из прогнозируемых вариантов).
соответствии с регламентом периодически подается слабый раствор BaCl2 и происходит выпадение осадков:
BaCl2+H2SO4=BaSO4 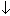 +2HCl
+2HCl
BaCl2+H2CO3=BaCO3 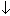 +2HCl
+2HCl
Аппарат (поз. 7) представляет из себя вертикальный реактор с якорной мешалкой Изготовлен из обычной стали и покрытый изнутри стеклоэмалью.
Таким образом в жидкой фазе остается водный раствор слабой соляной кислоты HCl. В осадок выпадает смешанная соль BaSO4·BaCO3. Далее суспензия BaSO4 Ч BaCO3 с остатками HCl направляется на центрифугирование в центрифугу (поз.8), где остатки HCl отделяются от осадка и направляются в емкость (поз.7) или прямо в специальную емкость сборник HCl (поз.11). Смесь солей после промывки водой и дробления пневмотранспортом направляются в емкость (поз.9), где производится нагрев этой смешанной соли. При этом сульфат бария BaSO4 плавится при t=+1580°С, а витерит разлагается:
BaCO3 + Q  BaO+CO2
BaO+CO2 
Далее смесь BaSO4·BaO охлаждается и после дробления направляется в емкость (поз.10). Емкость (поз.10) представляет из себя вертикальный аппарат с якорной мешалкой. Туда же подается вода для растворения ВаО и образования баритовой воды:
BaO+H2O=Ba(OH)2+Q............(7)
Баритовая вода остающаяся в растворе после перемешивания по регламенту идет в сборник, как товарный продукт. Сульфат бария BaSO4 в виде водной суспензии направляется на фугование (на рис. 15 не указано) и на сушку. При получении BaSO4 для медицинских целей продукт направляется сначала на перемывку, затем на фугование и уже потом на сушку.
Завершение процесса контролируется визуально по окончании пробулькивания газа в колоннах (поз.1,2,3) и инструментальными способами (соответствующими КИП). Разумеется предлагаемая прогнозируемая схема разделения кислот в процессе опытных испытаний потребует корректировки и уточнения. Так в частности вопрос о выборе емкости (поз.9) является весьма приближенным и потребуется существенная корректировка этой операции и главное существенная корректировка выбора аппарата (поз.9).
После завершения химико-технологического процесса переработки ТП и БО из ЭТР выгружается шлак, представляющий собой твердый многокомпонентный раствор. Шлак может быть различным в зависимости от загружаемых ТП и БО. Если загружается значительная часть СОЖ с отходами металла, то такой шлак может содержать металл до 70% и более. Такой шлак целесообразно использовать в зависимости от химического состава для переплавки скажем в чугун. Если СОЖ с остатками металла составляет незначительный процент от общего количества загружаемых ТП и БО, то можно прогнозировать, что конечный твердый продукт шлак будет мало содержать металла. Такой шлак нужно направлять на дробление и использовать его в качестве наполнителя для получения цементных растворов. Для этого в цементный раствор, находящийся в двухшнековом смесителе Вернера-Пфлейдерера разгружается дробленый шлак. После окончания загрузки шлака в заданном количестве производится перемешивание цементного раствора до полной гомогенности (однородности). После получения однородной массы производится формование строительных изделий (блоков и т.п.). Использовать шлак для дорожного строительства нельзя, т.к. при переработке ОХИТ возможно образование количественно кадмия (Cd) в шлаке после переработки в ЭТР. А кадмий, как известно, является опасным мутантом и в процессе эксплуатации дорожного покрытия он может медленно при старении покрытия экстрагироваться в близлежащий почвенный слой, что недопустимо.
Таким образом, в процессе переработки ТП и БО получаются следующие товарные продукты:
1. Синтез-газ или точнее смешанный газ представляющий смесь генераторного газа СО+N2 и водяного газа СО+Н2. Смешанный газ является хорошим энергоносителем. При сжигании 1м3 такого газа образуется ~2800-5000 ккал;
2. Шлак - твердый продукт, который следует использовать по двум направлениям:
а) при высоком содержании металла такой шлак следует направлять на переплавку; после обогащения и очистки для получения чугуна;
б) при низком содержании металла шлак используется как наполнитель для приготовления цементных растворов и последующего формования строительных блоков и т.п.;
3. Слабая (разбавленная) техническая соляная кислота (HCl);
4. Сульфат бария - технический продукт, или, если он подвергается очистке, то его уже можно использовать в качестве медицинского препарата (для анализа секреторной деятельности желудка человека);
5. Баритовая вода - Ba(OH)2 используется как химический реагент при проведении химического анализа газов на содержание CO2; SO3 и т.д.
Для выброса в окружающую природную среду вредных газообразных, жидких и твердых продуктов при данной переработке ТП и БО в электротермическом реакторе просто не образуется, если не считать диоксида углерода, образующегося при разложении BaCO3. Все получающиеся и перечисленные выше продукты жидкие, твердые и газообразные являются товарными продуктами. При сжигании синтез-газа не образуются никакие токсичные вещества.
Литература
1. Л.А. Федоров, Диоксины, как экологическая опасность: ретроспектива и перспективы, М., Наука, 1993, с.1-226.
2. В.Н. Сариев, Пути достижения оптимального хозяйствования твердыми муниципальными отходами//Информ. Сборник "Экология городов", М., №5, 1995, с.73-75.
3. А.Н. Сачков, К.С. Никольский, Ю.И. Маринин, О высокотемпературной переработке твердых отходов во Владимире//Информ. Сборник "Экология городов", М., №8, 1996, с.79-81.
4. Краткая химическая энциклопедия, М., С.Э., т.5, 1967, с.644-653.
5. Прокофьев В.И., Харитонова Н.Д., Митрофанова Н.М., Очистка стоков цеха переработки химических продуктов, Ж.//Кокс и химия, №11, 1985, с.51-53.
6. М.Х. Карапетьянц, С.И. Дракин, Общая и неорганическая химия, М., Химия, 1981, с.358-361, с.598, с.364-365, с.302, с.454, с.319, с.601, с.482, с.585, с.547.
7. Б.В. Некрасов, Курс общей химии, М., ГХИ, 1962, с.338-340, с.237, с.426-427, с.634-643, с.670-643, с.670-672, с.683.
8. Краткий справочник химика, Под ред. В.И. Перельмана, М., ГХИ., 1963, с.96-97, с.90-91, с.68-69, с.80-81, с.62-63, с.78-79.
9. Н.С. Ахметьев, Общая и неорганическая химия, М., ВШ, 1981, с.492.