Углерод. Кислородные соединения углерода.
Прочитайте и сделайте конспект по данной теме.
План урока.
1. «Химическая история»
2. Основные характеристики
3. Содержание углерода
4. Физические свойства
5. Химические свойства
6. Применение углерода С
7. Круговорот углерода в природе
1. «Химическая история»
Углерод является одним из первых химических элементов, который известен человеку. 3750 г. до н.э.
Углерод является одним из элементов, имя первооткрывателя которого неизвестно, неизвестно и то, какая из форм элементарного углерода – алмаз или графит – была открыта раньше. И то и другое случилось слишком давно, ещё до возникновения письма.
В 1791 г. английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокаленным мелом, в результате чего образовывался фосфат кальция и углерод.
Международное название Carboneum происходит от лат. carbo (уголь).
Соединения углерода имеют в названии часть карб(он) - от лат. carbō (род. п. carbōnis) «уголь».
2. Основные характеристики.
Углеро́д — химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Д. И. Менделеева. Порядковый номер 6. Электронная формула: 1 s2 2s2 2p2

Температура кипения: 4 827°C. Атомная масса: 12,0107 ± 0,0008 а. е. м.
Степень окисления: -4, +2, +4.
3. Содержание углерода.
· В земной коре - 0,27%
· В растительной клетке - 45%
· В животной клетке - 18%
· В человеческом теле - 10,5%
4. Физические свойства.
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами.
Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Известны четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит. И одна новая аллотропная модификация – графен (полупрозрачное вещество, с высокой проводимостью). Открытый в 2004 году. (2011 году Нобелевская премия – Андрей Гейм и Константин Новоселов).
Что же такое Аллотропия?
Аллотр о пия - (от греч. állos — другой и trópos — поворот, свойство), существование одного и того же химического элемента в виде двух или нескольких простых веществ, различных по строению и свойствам.
ГРАФИТ

Графит - серо-чёрная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском, обладает электропроводимостью.
Атомы расположены параллельными слоями, образуя гексагональную решетку.

Внутри слоя атомы связаны сильнее, чем один слой с другим, поэтому графит может расслаиваться.
Сгорает при 700оС в присутствии кислорода.
Встречается в природе; получается искусственно.
При высокой температуре, давлении и присутствии катализатора (марганец Mn, хром Cr, платиновые металлы) графит превращается в алмаз.
АЛМАЗ – будущий бриллиант

Алмаз - минерал, имеющий желтоватый, белый, серый, зеленоватый, реже голубой и черный цвет.
Не проводит электрический ток, но имеет высокую теплопроводность.
В кристалле атомы углерода образуют непрерывный трехмерный каркас, состоящий из сочлененных тетраэдров, что обеспечивает высокую прочность связей.

Алмаз - это самое твердое вещество из всех известных.
Температура плавления выше 3500оС. Химически стоек. Сгорает при 870оС в присутствии кислорода. При 1800оС в отсутствие кислорода превращается в графит.
Прозрачные кристаллы; после обработки - бриллианты.

Добывают из россыпей и коренных месторождений. Синтетический алмаз получают из графита при высоком давлении и температуре. 1 карат = 0,2 г.
КАРБИН
Получен искусственно.
Он представляет собой мелкокристаллический порошок чёрного цвета.
Построен из длинных цепочек атомов С, уложенных параллельно друг другу.
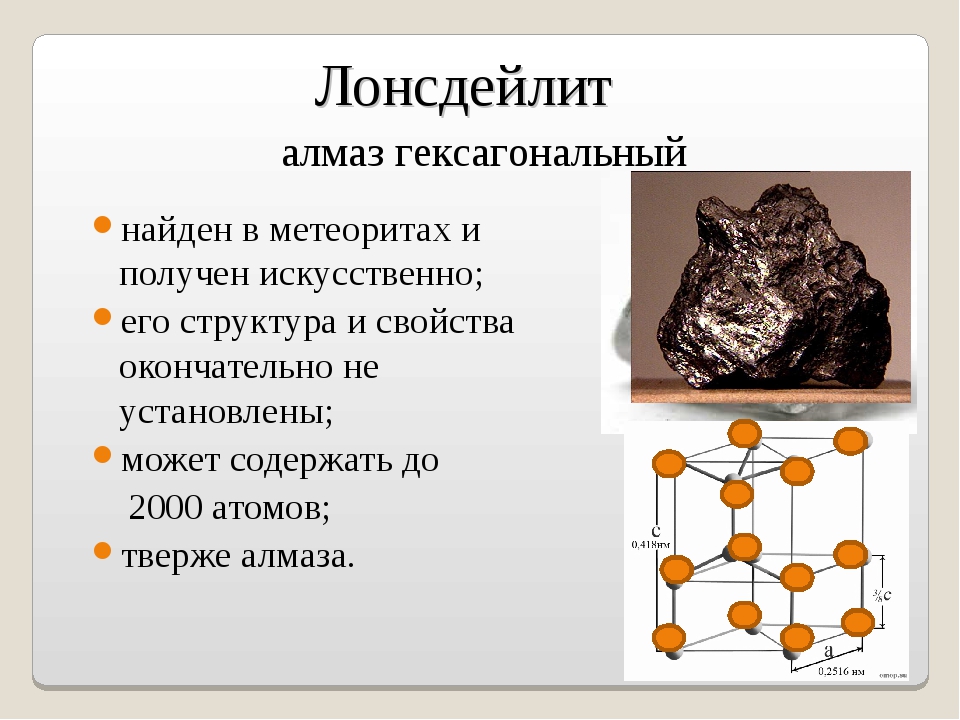
ЛОНСДЕЙЛИТ
Сажа и древесный уголь – стр. 235.
5. Химические свойства.
При обычных условиях углерод химически инертен, при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства.
Все формы углерода устойчивы к щелочам и кислотам и медленно окисляются только очень сильными окислителями (хромовая смесь, смесь концентриров. HNO3 и KCIO3 и др.).
“Аморфный” углерод реагирует с фтором при комнатной температуре, графит и алмаз - при нагревании.
С бромом и йодом углерод не реагирует. С фтором на холоде.
Рассмотрим химические свойства углерода, с позиции ОВР, то есть рассмотрим углерод как восстановитель и как окислитель, в химических реакциях.
1.С неметаллами
С + S = CS2
C + O2 = CO2↑ — оксид углерода (IV) - кислотный оксид
При недостатке кислорода:
2C + O2 = 2CO↑ —оксид углерода (II) - несолеобразующий оксид
С + 2H2 = CH4↑
С + Si =SiC — карбид кремния.(карборунд)
2.С металлами
3C + 4Al →Al4C3 — карбид алюминия
3.С водянным паром
C + H2O → CO + H2 - водяной газ.
4.С оксидами металлов
С + 2CuO → 2Cu + CO2↑
2FeO + C = 2Fe + CO2
5.С оксидом углерода
C + CO2 = 2CO↑
6. Применение углерода С.
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент.
В частности углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)
Графит используется в карандашной промышленности, но в смеси с глиной, для уменьшения его мягкости.
Также его используют в качестве смазки при особо высоких или низких температурах.
Его невероятно высокая температура плавления, позволяет делать из него тигли для заливки металлов.
Способность графита проводить электрический ток также позволяет изготавливать из него высококачественные электроды.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин.
Кроме этого, ограненные алмазы - бриллианты используются в качестве драгоценных камней в ювелирных украшениях.
Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров.
В фармакологии и медицине широко используются различные соединения углерода.
Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний.
И это конечно же не все области применения модификаций углерода. см.
Вспомнить о применении Графена.
7. Круговорот углерода в природе. Стр. 238
Углерод является основой всех органических веществ.
Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни.
Источником углерода для живых организмов обычно является СО2 из атмосферы или воды.
В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела.
Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
Схема «Круговорот углерода в природе» см. стр. 240