Углерод образует два оксида — оксид углерода (II) СО и оксид углерода (IV) СO 2.
Оксид углерода (II) СО — бесцветный, не имеющий запаха газ, малорастворимый в воде. Его называют угарным газом, так как он очень ядовит. Попадая при дыхании в кровь, он быстро соединяется с гемоглобином, образуя прочное соединение карбоксигемоглобин (объясните происхождение этого термина), тем самым лишая гемоглобин возможности переносить кислород. При вдыхании воздуха, содержащего 0,1% СО, человек может внезапно потерять сознание и умереть.
Угарный газ образуется при неполном сгорании топлива (напишите уравнение соответствующей химической реакции), вот почему так опасно преждевременное закрывание дымоходов печей (рис. 152).

Оксид углерода (II) относят, как вы уже знаете, к несолеобразующим оксидам. Будучи оксидом неметалла, он должен реагировать с щелочами и основными оксидами с образованием соли и воды, однако этого не наблюдается.
СО — хороший восстановитель (почему?). Он сгорает в кислороде, образуя углекислый газ:
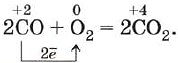
Оксид углерода (II) способен отнимать кислород у оксидов металлов, т. е. восстанавливать металлы из их оксидов:
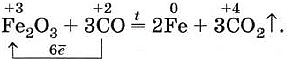
Именно это свойство оксида углерода (II) используют в металлургии при выплавке чугуна.
Оксид углерода (IV) СO 2 — бесцветный, не имеющий запаха газ, широко известный под названием углекислый газ. Он примерно в полтора раза тяжелее воздуха. При обычных условиях в одном объёме воды растворяется один объём углекислого газа.
При давлении примерно 60 атм углекислый газ превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его превращается в твёрдую снегообразную массу, которую в промышленности прессуют, — это известный вам «сухой лёд», который применяют для хранения пищевых продуктов. Вы уже знаете, что твёрдый углекислый газ имеет молекулярную решётку и способен к возгонке (что это такое?).
Углекислый газ СO 2 как типичный кислотный оксид взаимодействует с щелочами (например, вызывает помутнение известковой воды), с основными оксидами и водой. Он не горит и не поддерживает горения (рис. 153) и потому применяется для тушения пожаров.
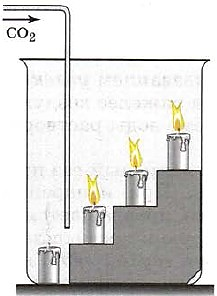
Гашение пламени углекислым газом
Однако магний продолжает гореть в углекислом газе с образованием оксида и выделением углерода в виде сажи:
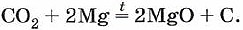
Углекислый газ получают, действуя на соли угольной кислоты — карбонаты растворами соляной, азотной и даже уксусной кислот. В лаборатории углекислый газ получают при действии соляной кислоты на мел или мрамор (рис. 154):


Лабораторная установка для получения углекислого газа
В промышленности углекислый газ получают обжигом известняка:
 Углекислый газ используют также для изготовления шипучих напитков и получения соды.
Углекислый газ используют также для изготовления шипучих напитков и получения соды.
Применение углекислого газа показано на рисунке 155 стр. 245
При растворении оксида углерода (IV) в воде образуется очень нестойкая угольная кислота Н 2 СO 3, которая легко разлагается на исходные компоненты — углекислый газ и воду:

Будучи двухосновной, угольная кислота образует два ряда солей: средние — карбонаты, например СаСO 3, и кислые — гидрокарбонаты, например Са(НСO 3) 2. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Кислые соли, как правило, растворимы в воде.
При избытке углекислого газа в присутствии воды карбонаты могут превращаться в гидрокарбонаты. Так, если через известковую воду пропускать углекислый газ, то она сначала помутнеет из-за выпавшего в осадок нерастворимого в воде карбоната кальция, однако при дальнейшем пропускании углекислого газа помутнение исчезает в результате образования растворимого гидрокарбоната кальция:
СаСO 3 + Н 2 O + СO 2 = Са(НСO 3) 2
Именно наличием гидрокарбонатов кальция и магния в природной воде и объясняется её временная жёсткость. Т.к. при нагревании растворимый гидрокарбонат кальция снова превращается в нерастворимый карбонат:

Эта реакция приводит к образованию накипи на стенках котлов, труб парового отопления и домашних чайников. В природе в результате этой реакции в пещерах формируются свисающие вниз причудливые сталактиты, навстречу которым снизу вырастают сталагмиты.
Другие соли кальция и магния, в частности хлориды и сульфаты, придают воде постоянную жёсткость, которую невозможно устранить кипячением. Для удаления солей, вызывающих постоянную жёсткость, приходится использовать другой карбонат — соду Na 2 CO 3, которая переводит ионы Са 2+ в осадок, например:
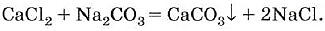
Соду можно использовать и для устранения временной жёсткости воды.
Карбонаты и гидрокарбонаты можно обнаружить с помощью растворов кислот: при действии на них кислот наблюдается характерное «вскипание» из-за выделяющихся пузырьков углекислого газа (рис. 157):

Эта реакция является качественной на соли угольной кислоты.
Домашнее задание.
§ 33, 34. Упр.6 на стр. 249
Рассмотрите реакцию восстановления оксида железа (III) (см. выше) оксидом углерода (II) как окислительно-восстановительный процесс (составить электронный баланс).